
테넬리글립틴(Teneligliptin)
1. J-자형 구조의 분자적 특성
1.1 테넬리글립틴의 분자식
- 분자식: C22H30N6O2S
- 분자량: 442.58 g/mol
1.2 5개의 고리 시스템
테리글립틴의 J-자형 구조는 5개의 고리 시스템으로 구성되어 있습니다. 각각의 고리는 분자의 기능적 특성과 효소와의 결합에 기여합니다.
- 피롤리딘 고리 (Pyrrolidine): 친수성을 부여하며, 효소의 활성 부위에 접근성을 높임.
- 피페라진 고리 (Piperazine): 효소의 친화력을 증가시키며, DPP-4와의 상호작용에서 중요한 역할을 함.
- 설파닐아미드 그룹 (Sulfonamide): DPP-4와 강한 수소 결합을 형성하여 결합 안정성을 증가시킴.
- 페닐 고리 (Phenyl): 소수성 상호작용을 통해 효소 활성 부위에 깊이 결합.
- 테트라히드로피란 고리 (Tetrahydropyran): 분자 안정성과 입체 화학적 정렬을 제공.
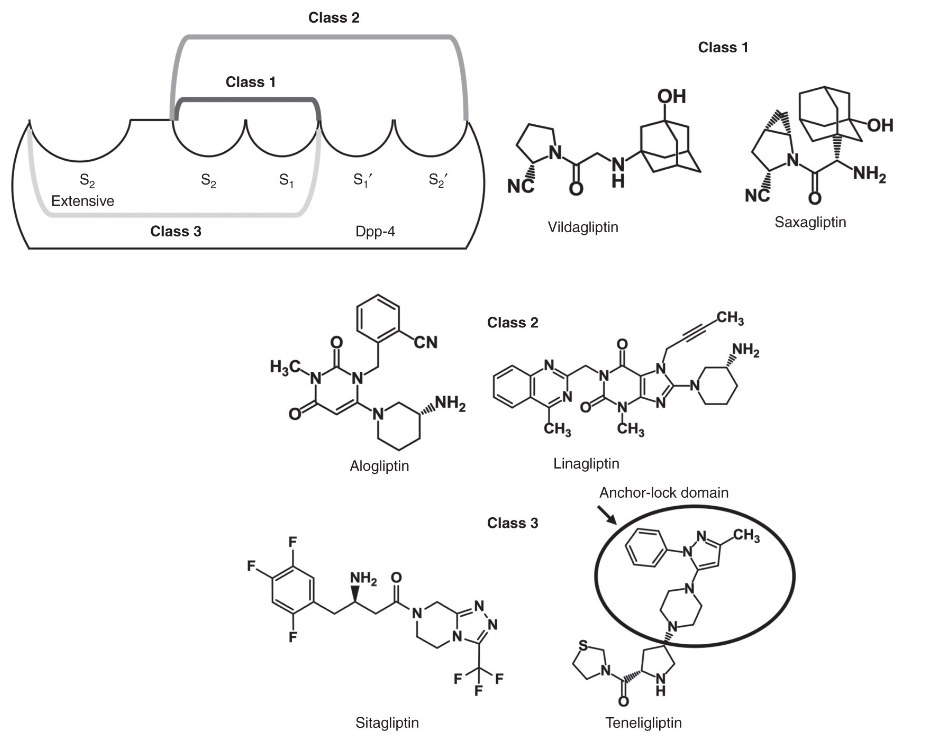
Structure and classification of the DPP-4 inhibitors, showing the J-shaped structure and anchor-lock domain of teneligliptin.
DPP-4 inhibitors are structurally diverse and can be classified into three classes based on their interaction with DPP-4 binding subsites Citation[18]. Teneligliptin is grouped into class 3, owing to its interaction with S1, S2, and S2 extensive subsites Citation[18].
It is a potent, selective, and long-lasting inhibitor of DPP-4 and exhibits strong binding via its J-shaped structure and ‘anchor lock domain’.
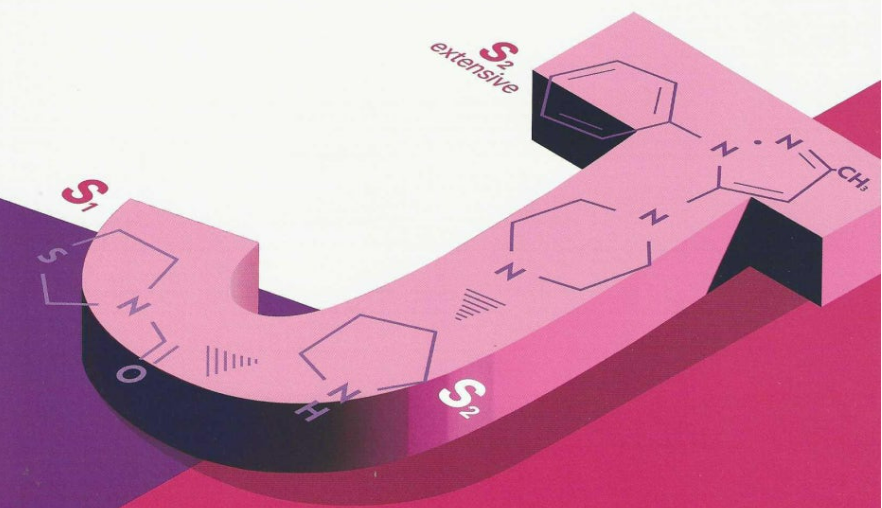
2. J-자형 구조의 화학적 역할
2.1 입체화학적 배치
- J-자형 구조는 DPP-4 효소 활성 부위에 적합한 입체적 배치를 제공하여 분자-효소 상호작용의 강도를 극대화합니다.
- 효소의 촉매 부위에 있는 Ser630, Tyr547, Glu205, Glu206 등의 잔기와 복합적인 상호작용(수소 결합, 소수성 결합)을 유도합니다.
2.2 효소 저해 메커니즘
- 비가역적 결합이 아닌 선택적 가역적 결합: 테리글립틴은 DPP-4 효소의 활성 부위에 가역적으로 결합합니다. 이로 인해 효소의 자연적인 대사 활동을 유지하면서도 혈당 조절에 필요한 억제 효과를 발휘합니다.
- 효소의 S1, S2 포켓과의 강한 결합: DPP-4의 S1 포켓(아미노산 결합 부위)과 S2 포켓(소수성 부위)에 동시에 작용하여 효소를 안정적으로 억제합니다.

3. DPP-4 효소와의 상호작용
5.1 수소 결합
- 설파닐아미드와 효소의 아미노산 사이에 강력한 수소 결합이 형성됩니다. 이는 효소-억제제 복합체의 결합력을 강화합니다.
5.2 소수성 상호작용
- 페닐 고리와 테트라히드로피란 고리가 효소의 소수성 부위와 결합하여 약물의 위치를 고정시킵니다.
참고문헌 : https://www.tandfonline.com/doi/full/10.1517/14656566.2015.1000301#d1e240
'내분비내과 > 당뇨병' 카테고리의 다른 글
| 문정역내과, SGLT2i : 혈당조절 효능, 전체 사망률, 체중감소 (0) | 2024.08.15 |
|---|---|
| 문정동내과 당뇨병 신경병증 치료제 항산화제 (알파지방산, 감마 리놀렌산) : 덱시드정480mg, 에보프림연질캡슐 (0) | 2024.08.06 |
| Red cell turnover가 당화혈색소에 미치는 영향 (0) | 2024.03.27 |
| 문정동내과 당뇨 말초 신경병증 (diabetic peripheral neuropathy) (0) | 2024.03.25 |
| 당뇨병성 심혈관 자율신경병증, Diabetic cardiovascular autonomic neuropathy (CAN) (1) | 2024.03.22 |



