
서 론
크로이츠펠트-야콥병(Creutzfeldt-Jakob disease, CJD) 은 사람에서 발생하는 전염성 해면상뇌병증(transmissible spongiform encephalopathies) 또는 프리온(prion, ‘pree-ON’ 으로 발음) 질환으로 치명적인 신경계의 퇴행성 질환 중 하나로 알려져 있다[1]. 프리온(prion)은 감염병 단백질 입자로 단백질(protein)과 감염(infection)의 단어에서 파생된 용어이며 1982년 Prusiner [2]가 질병에 관련된 단백질을 확인하면서 만들어졌다. 일반적으로 프리온은 외부에서 유입된 것이 아니라 인체 내에 정상적으로 존재(cellular prion protein, PrPC )하고 있고 사람의 경우 20번 염색체(chromosome 20)에서 유래되는 단백질이며 이 단백질의 정보를 암호화하고 있는 유전자를 prion protein (PRNP) 유전자라고 한다[3]. 정상 프리온 단백질의 정확한 기능은 확실하게 밝혀지진 않았지만 CJD와 같은 프리온 질병은 PrPC의 오접힘(misfolding)에 의한 변형 프리온 단백질(scrapie prion protein, PrPsc)이 중추신경계에 축적되면서 발병된다(그림 1) [4,5]. 이러한 구조적 변화를 유발하는 기전은 아직 알려지지 않았지만 PrPsc의 축적은 신경세포의 공포(vacuole)형성, 해면상 변화 등을 일으켜 발병할 경우 예외 없이 사망하는 치명적인 신경퇴행성 질환을 초래한다 [1,3]. 또한, PrPsc는 일반적으로 행하는 소독 방법과는 다른 소독 방법이 필요하여 관리가 어렵기 때문에 환경에 노출될 경우 주변으로 전파될 수 있는 위험을 가지고 있다[4]. 인간에서 확인되는 CJD의 PrPsc 표현형, 역학적 특성 및 발병기전은 매우 다양하며 이러한 정보를 기반으로 CJD는 산발성, 유전형, 획득형으로 구분된다[1]. 자연적으로 발생하는 산발성 CJD (sporadic CJD, sCJD)는 가장 흔하게 확인되는 인간 프리온 질환으로 전체 CJD의 약 85%를 차지하고 있다[1-3]. 유전형 CJD로는 가족성 CJD (familial CJD, fCJD)가 대표적이고 주로 PRNP 유전자 변이에 의해 발생하며 전체 약 10–15%를 차지한다[1,6]. 이외 1%는 외부 요인 획득으로 인해 발병하는 의인성 CJD (iatrogenic CJD, iCJD)와 변종 CJD (variant CJD, vCJD)가 있다[1]. 주요 외부요인으로는 iCJD의 경우 인간 뇌하수체 성장 호르몬 투여, 뇌경막 이식, 안과 시술 등의 수술 과정에서 오염된 기기 사용에 의한 것이 대표적이고 영국에서 주로 발생되는 vCJD 경우는 소 질병인 소해면 상뇌병증(bovine spongiform encephalopathies)에 감염된 쇠고기 섭취 등과 관련이 있다고 알려져 있다[1,4,7].


sCJD의 평균 생존기간은 약 6개월 정도로 실제로 환자의 90% 이상이 증상 발현 후 1년 이내에 사망한다. 주로 70대에서 발병률이 가장 높은 것으로 알려져 있고 20–40대나 80대 이상에서는 발병률이 매우 낮으며 주요 증상으로는 급속히 진행하는 치매와 같은 인지장애, 운동실조, 공간지각력 장애, 우울증과 같은 감정 장애 등이 있다[7,8]. fCJD와 iCJD의 임상증상은 sCJD와 비슷하지만 발생 연령이 fCJD는 50–60대, iCJD는 수술 종류에 따라 평균 9.6–37.7세로 다양하며, fCJD 는 증상 발현 후 6개월 이내, iCJD는 12–28개월 이내에 대부 분 사망한다[7]. vCJD는 발병 초기부터 우울증, 정신위축 등의 정신 증상과 팔다리 감각 이상이 나타나는 것이 특징적이 고, 평균 발생 연령이 26세로 비교적 낮으며 증상 발현 후 14개월 이내로 사망한다[4,7].
현재 CJD의 공인된 검사법은 뇌 조직검사 또는 부검을 통해 확보된 검체를 처리하여 단백질분해효소 내성 프리온 단백질(protease resistant PrP)을 측정함으로써 PrPsc로 확진하는 방식이다[9]. 그러나 이러한 방식은 낮은 부검률 등, 현실적으로 CJD를 확진하는 데는 한계가 있기 때문에 현재 전문의의 임상소견과 실험실 진단 결과를 활용한 추정을 통해 진단하고 치료한다. 우리나라도 CJD 전문가로 구성된 사례판정위원회 운영을 통해 환자의 임상증상, 과거병력, 뇌파(electroencephalogram, EEG)/자기공명영상(magnetic resonance imaging, MRI) 검사 결과 등을 종합하여 CJD 발병 여부를 판정하고 있다. CJD의 조기 진단은 오염된 수술 기구의 사용과 같은 인체 내에 인위적으로 전파될 수 있는 위험을 최소화할 수 있기 때문에 매우 중요하다. 이 글에서는 신속한 CJD 진단을 위해 주요하게 활용되는 다양한 실험실 검사법을 소개하고 그 이해를 돕고자 한다.
방 법
질병관리청, 국제 CJD 연구 및 감시 기구(National CJD Research & Surveillance Unit), 미국 질병통제예방센터 (Centers for Disease Control and Prevention)의 발간자료 및 문헌 조사를 통해 CJD의 실험실 진단 검사법에 대한 내용을 조사, 정리하여 서술하였다.
결 과
1. 14-3-3 단백질 검출 검사
14-3-3 단백질은 1967년 소의 뇌조직으로부터 단백질 을 분리하는 과정에서 14번 샘플의 전기영동 결과에서 3.3번 위치에서 발견되었기 때문에 ‘14-3-3’이라고 명명된 단백질로, 다양한 조직에서 발현되나 특히 뇌조직에서 많이 발현하는 30 kDa 크기의 단백질이다[10]. 14-3-3 단백질은 뉴런의 분화, 생존, 신경돌기의 생장, 이온채널의 조절과 같은 기능을 수행하는데 CJD 환자에서 발현양이 상승된 것으로 알려져 진단에 있어 중요한 바이오마커로 활용된다[10]. 특히, sCJD를 추정 진단하는 데에는 웨스턴 블랏(Western blot)을 이용한 14-3-3 단백질의 검출법을 채택하여 사용하고 있다[9,11]. 14-3-3 단백질 검출검사는 sCJD 79%, fCJD 82%, iCJD 100%로 민감도가 매우 높지만, vCJD는 약 50%로 상대적으로 낮다[12]. 이 시험법은 CJD 외에도 뇌졸중, 간질지속증, 염증성 뇌병증과 같은 다른 뇌질환에서도 14-3-3 단백질 발현량이 증가하기 때문에 위양성의 가능성이 있다는 제한점이 있다. 이 경우 신경 손상을 확인하는 또 다른 바이오마커인 타우 단백질 검출을 추가하여 진단함으로써 14-3-3 단백질 검출 검사를 보완하여 사용할 수 있다[11].
2. PRNP 유전자 변이 분석
프리온 단백질을 암호화하는 PRNP 유전자는 253개의 아미노산으로 구성된다[6]. PRNP 유전자에 점 돌연변 이나 octapeptide repeats의 삽입/결실(octapeptide repeats insertion/deletion [OPRI/OPRD])과 같은 돌연변이가 발생할 경우, fCJD, Gerstmann-Sträussler-Scheinker disease, fatal familial insomnia (FFI) 등과 같은 유전형 프리온 질환을 유발하는 것으로 보고되고 있다[12]. 이러한 유전형 프리온 질환들은 상염색체 우성의 방식으로 유전되어 여러 가족 구성원에서 발생하는 특징을 갖는다[3]. PRNP 유전자 변이 분석은 CJD 의심환자의 혈액으로부터 DNA를 추출하여 PRNP 유전자를 중합효소연쇄반응(polymerase chain reaction)을 통해 증폭한 후 염기서열분석을 통해 돌연변이의 유무를 파악한다.
1) 유전자 아미노산 변이 탐색
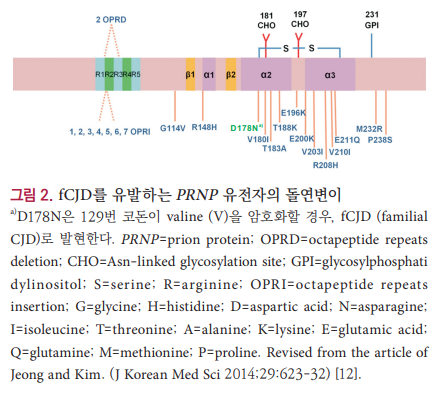
PRNP 유전자의 돌연변이는 정확한 메커니즘이 밝혀지지 않았지만 변형된 프리온 단백질로의 발현을 유발하며, 현재까지 50개 이상의 변이가 보고되었다[12]. PRNP 유전자의 여러 돌연변이 중 fCJD는 G114V, R148H, D178N-129V, V180I, T183A, T188K, E196K, E200K, V203I, R208H, V210I, E211Q, M232R, P238S의 점 돌연변이 등으로부터 발생하며 E200K가 가장 대표적인 돌연변이다(그림 2) [12].
2) 다형성 유전자 탐색
PRNP 유전자는 다양한 다형성을 갖는 부위가 존재하는데, 그 중 가장 대표적인 부위가 PRNP 129번 코돈의 methionine (M)과 valine (V)에 의한 다형성으로 각각 동종접 합형(M/M, V/V)과 이종접합형(M/V)으로 나타난다. PRNP 129번 코돈 다형성은 사람에서 발병하는 프리온질환에서 매우 위험한 유전적 요인이며, 국가, 인종 별로 그 비율이 다른 것으로 알려져 있다[12]. 유럽의 경우 일반인의 약 49%만 M/ M 동종접합형으로 확인되고 있지만 sCJD 환자의 80%, vCJD 환자의 100%가 M/M 동종접합형으로, 인구의 94%가 M/M 동종접합형인 우리나라의 sCJD 환자는 100%가 M/M 동종접합형으로 확인되었다[12]. 이외에도 129번 코돈의 다형성은 178번 코돈 aspartic acid (D)가 asparagine (N)로 변이되는 것과 관련해 임상양상이 다르게 나타나는데 129번 코돈이 M/ M 동종접합형인 경우는 FFI로 나타나고 M/V 이종접합형인 경우는 fCJD로 진단한다[7,12].
3. 실시간진동유도변환법을 이용한 변형 프리온 단백질 검출 검사법
1) 실시간진동유도변환법
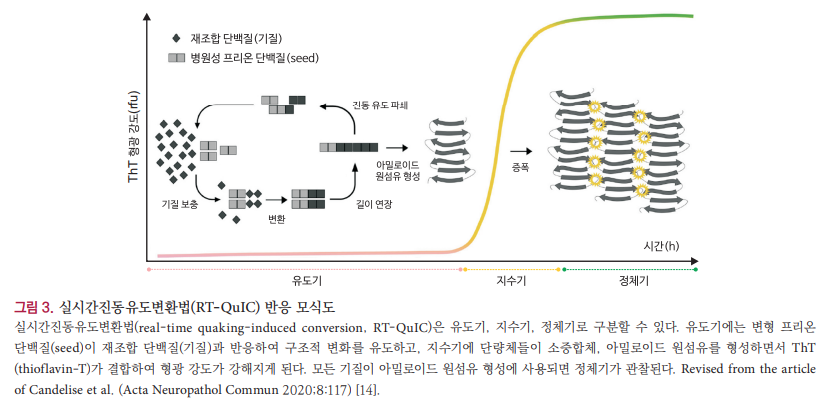
실시간진동유도변환법(real-time quaking-induced conversion, RT-QuIC)은 뇌척수액(cerebrospinal fluid, CSF) 에서 PrPsc를 직접 검출하여 다른 시험법에 비해 현저하게 높은 민감도와 특이도를 나타내기 때문에 주목받고 있는 CJD 진단법이다. 이 방법은 재조합 PrP를 종자(seed)로 사용한 다음 PrPsc가 포함된 CSF를 추가하여 응집되도록 유도한다. 이후 반응시약에 포함된 thioflavin-T (ThT)는 응집된 PrPsc와 결합하여 ThT 형광 스펙트럼을 변화시키고 그 반응을 실시간으로 측정하여 확인한다(그림 3) [13,14]. RT-QuIC는 극소량(1 fg) 의 PrPsc도 검출이 가능하고 뇌 균질액, CSF, 혈장, 후각 점막 등 다양한 검체를 활용하여 검사할 수 있으며 자동화된 반응 시스템, 그리고 높은 민감도와 특이도를 가져 획기적인 새로운 검사법으로 평가되면서[14,15], 2018년부터 sCJD를 진단 하는 시험법으로 추가하고 있다[11]. RT-QuIC는 여러 연구를 통해 반응 조건이 조금씩 변화 해왔는데, 현재에는 크게 1세대와 2세대 방법으로 구분할 수 있다[13]. 1세대 RT-QuIC는 재조합 PrP의 프리온 단백질 (23–231 amino acids [aa])을 대상으로 하고[14,15], 민감도는 73–100%였으며, 특히 특이도는 98–100%로 음성 검체에 대한 구분 능력이 뛰어나다고 알려졌다[13]. 시험법의 정확성 및 효율성을 확보하기 위한 지속적인 연구를 통해 개발된 2세대 RT-QuIC는 N 말단이 절단된 재조합 PrP의 프리온 단백질(90-231aa)을 사용하여 반응 조건을 변경시켜서 반응 시간을 단축시켰을 뿐 아니라 민감도는 91–100%, 특이도는 98.5–100%로 향상시켰다[14,15].
2) Enhanced quaking-induced conversion 시험법
RT-QuIC는 일반적인 CJD 진단에서는 유용하게 활용되지만 vCJD는 민감도 25%로 반응이 억제된다는 한계가 있다 [11]. 이를 개선하기 위해 기존의 RT-QuIC 시험법에 면역 침강법(immunoprecipitation, IP)을 접목하여 ‘강화된 QuIC (enhanced QuIC, e-QuIC)’이라는 검사법을 개발하였다[16]. e-QuIC는 혈장에 vCJD 환자의 뇌 균질액을 희석하여 첨가한 후, PrPsc 특이 항체를 사용함으로써 PrPsc 단백질을 검출한다 [16]. 이 시험법은 기존 RT-QuIC의 vCJD에 대한 낮은 민감도를 개선하고 반응 억제 물질이 많은 혈액에서 기존보다 낮 은 농도에서 PrPsc을 검출했다는 점에서 발전된 검사법이라고 할 수 있으나, 시험법을 표준화시키기 어렵고 재현성이 떨어진다는 단점이 있다[15].
논의(결론)
CJD의 원인 병원체인 프리온 단백질은 세균, 바이러스 등의 다른 감염성 병원체들과 특성, 발생 경로, 진단 방법 등이 전혀 다른 새로운 병원체이다. 또한, CJD는 수개월에서 수년에 이르는 잠복기가 매우 길고 염증 반응 및 질병 특이적인 면역반응 등 전조 증상이 전혀 나타나지 않기 때문에 임상 증상이 나타나기 전까진 CJD 발병 여부를 알 수 없으며, 아직까지 치료법이 없어 발생하면 100% 사망한다는 위험성을 가지고 있다. 일반적으로 CJD는 호흡기나 접촉을 통해 전파되는 전염병은 아니지만 iCJD나 vCJD의 경우는 전파 위험성과 발병 원인이 의료, 축산 등의 사회적 문제와 연관될 수 있기 때문에 경각심을 가지고 관리해야 한다.
전 세계적으로 발생하는 CJD 환자는 매년 백만 명당 1–2 명씩 보고되고 있으며, 그 발생 건 수도 최근 점점 증가하는 추세이다[1,4,17-19]. 우리나라는 2011년부터 CJD 환자에 대한 전수 감시를 실시하고 있다. 국내 CJD 환자는 다른 주요 발생 국가에 비해 발생 건 수는 적은 편이지만 연간 발생 신고 건 수가 29–65건 집계되고 있으며 특히, 전수검사를 시작한 2011년에 비해 2021년 기준 2배 이상 발생이 증가하는 것이 확인되었다[20].
이와 관련하여 국내에서도 CJD 환자 관리와 진단의 중요성 역시 함께 증가하고 있다. 그러나 현실적으로 CJD 확진을 위한 부검이 국내 실정상 쉽지 않기 때문에 CJD 환자 진단은 대부분 추정진단에 의존하고 있다[5,20]. 국내 CJD 추정 진단은 환자의 임상 증상, EEG/MRI 검사, 실험실 검사 결과 등을 종합하여 관련 분야 전문가들로 구성된 CJD 사례판정위원 회에서 판정하고 있는데, 표 1의 판정 기준과 같이 판정하는 데 있어 실험실 검사 결과가 반드시 필요하므로 가장 중요시 되고 있다. CJD 진단 검사법의 종류가 다양하지만 각각의 검사 결과가 의미하는 것이 다르고, 이를 종합한 결과가 CJD 환자를 분류하는 데 꼭 필요하므로 데이터를 다각적으로 분석 해야 정확한 진단이 이루어질 수 있다. 또한, 각각의 검사법 이 다른 한계점을 가지고 있기 때문에 여러 검사법의 결과로 이를 보완하는 것은 반드시 필요한 과정이다. 14-3-3 단백 질 검출 검사의 경우, 아밀로이드 원섬유의 축적으로 인해 뇌 조직이 파괴되는 것을 CSF 내 14-3-3 단백질 양의 증가로 판 단할 수 있지만, 다른 퇴행성 뇌질환과의 감별력이 떨어진다 [11]. 그러므로, 다른 바이오마커인 타우 단백질 검출 결과나 RT-QuIC를 이용한 PrPsc 검출 결과와 비교하여 위양성 여부를 교차검증하는 것이 중요하다. PRNP 유전자 변이 분석의 경우, CJD에 대한 유전 가능성을 파악해볼 수 있지만 발병 여부를 직접적으로 판단할 수는 없으므로 14-3-3 단백질 검출 결과 혹은 RT-QuIC 결과와 함께 종합적으로 분석해야 한다. 이러한 CJD 진단의 특성을 고려하여 의료 기관에서는 환자의 임상 증상과 뇌파검사 결과 등을 통해 CJD가 의심될 경우, 정확한 진단과 효율적인 환자 관리를 위해 다양한 실험실 검사 를 함께 의뢰하는 것이 필요하다.

'기타 > 기타' 카테고리의 다른 글
| 고산병 예방약 - 아세타졸라마이드와 덱사메타손 (0) | 2023.08.15 |
|---|---|
| 임신부 아토피 발진, Atopic Eruption of Pregnancy (0) | 2023.01.29 |
| 급성 허혈성 뇌졸증 치료에서 tenecteplase 0.4 mg/kg에 대한 안전성 (0) | 2022.08.05 |
| 편두통약, 트립탄, Triptans in migraine (0) | 2022.07.27 |
| 경동~중등도 통증 발작, 편두통 치료제 (0) | 2022.06.08 |



