결핵 진료지침 2020 [부록]


비결핵 항산균(nontuberculous mycobacteria; NTM)은 결핵균과 나병균을 제외한 항산균을 말한다. NTM은
현재까지 150여 종이 넘는 균종이 알려져 있으며 계속 새로운 균종이 밝혀지고 있다. NTM으로 인한 질환은
(1) 폐질환, (2) 림프절염, (3) 피부, 연조직, 골감염증, (4) 파종성 질환(disseminated disease) 등 4가지 특징적인
임상 증후군으로 분류된다. 이 중 폐질환은 NTM으로 인한 질환의 90% 이상을 차지하는 가장 흔한 형태이며,
국내에서도 최근 임상 검체에서 NTM이 분리되는 빈도와 NTM 폐질환으로 진단, 치료 받는 환자들이 증가하고 있다.

대부분의 NTM은 자연수와 토양 등 자연환경에 널리 분포하고 있으며, 병원성이 낮은 균이다. 사람과 사람
사이에서의 전염은 일반적으로 없으며, 따라서 NTM에 감염된 환자를 격리할 필요는 없다. NTM 폐질환은 주
위환경에 존재하는 균이 공기를 통해 호흡기에 감염되어 발생하며, 소아에서 주로 발생하는 NTM 림프절염과
후천면역결핍증후군 환자에서 발생하는 파종성 질환은 경구를 통한 오염된 물의 섭취가 질병 발생에 중요한
것으로 여겨지고 있다.
NTM 폐질환을 일으키는 원인균의 분포는 국가에 따라 그리고 국가 내에서도 지역에 따라 다양하다. 국내에서는
1981년 Mycobacterium avium complex 폐질환 증례가 처음으로 보고된 이후 1990년대 다양한 원인균에
의한 NTM 폐질환 증례가 보고되었다. NTM 폐질환의 국내 역학자료는 2000년 이후 많이 발표되었는데 현재
까지 국내 연구결과를 종합하면 우리나라에서도 NTM 폐질환의 원인균으로 가장 흔한 균은 M. avium
complex이다. 두 번째로 흔한 균은 M. abscessus complex이다. M. kansasii 폐질환은 국내에서 환자 수가
조금씩 증가하고 있지만 아직까지는 상대적으로 드물게 발생하고 있다.

자연계에 감염보유숙주가 없는 결핵균과 달리 NTM은 토양과 자연수 등 자연환경에 정상적으로 널리 분포하고
있다. 따라서 객담과 기관지 세척액 등 호흡기 검체에서 NTM이 분리되었다고 해서 이것이 NTM 폐질환의
증거라고 할 수 없다. 또한 균종에 따라 질환을 일으키는 발병력(virulence, pathogenic potential)이 달라,
M. kansasii, M. avium complex, M. abscessus complex 등은 상대적으로 발병력이 크고, M. fortuitum은
상대적으로 발병력이 낮다. M. gordonae는 대표적인 검사실 내 오염균으로 간주되고 있다. 이는 호흡기 검체에서
NTM이 분리되었을 때, NTM이 분리되었다는 사실 자체보다는 정확한 균 동정이 더욱 중요하다는 것을 의미한다.
M. avium complex, M. abscessus complex 등 NTM 폐질환의 흔한 원인균이 호흡기 검체에서 분리되었을 때
약 40-50%의 환자가 NTM 폐질환으로 진단된다.
따라서 객담 등 호흡기 검체에서 NTM이 분리되었을 때 오염균 또는 집락균과 폐질환의 원인균과의 구별을
위해서는 정확한 균 동정과 함께 적절한 임상적, 방사선학적, 미생물학적 기준에 따른 진단이 필요하다. 2007년
미국흉부학회(American Thoracic Society)와 미국감염학회(Infectious Diseases Society of America)에서
발표한 진단기준이 현재 전 세계적으로 사용되고 있다. 진단기준은 임상적으로 호흡기 증상을 가지고 있으면서,
방사선학적으로 흉부X선검사에서 결절성 또는 공동성 병변이 있거나 고해상도 전산화단층촬영에서 다병소의
기관지확장증 혹은 이에 동반된 다발성 소결절을 가진 환자에 적용된다. 미생물학적으로 도말 결과와는 상관없이
첫째, 최소한 2회 객담 검사에서 배양 양성을 보이거나 둘째, 최소한 기관지 세척액 1회에서 배양 양성인 경우
그리고 셋째, 경기관지 폐생검 등 조직배양이 양성이거나 또는 조직검사에서 육아종 등 항산균 감염의 병리학적
증거가 있으면서 1회 이상 객담 또는 기관지 세척액에서 배양이 양성이어야 한다(표 1).
NTM 폐질환은 방사선학적 이상소견의 변화속도가 매우 느리다. 따라서 객담에서 NTM이 분리되었을 때
그 임상적 의의를 평가하기 위해서는 충분한 추적관찰기간이 매우 중요하다. 수개월 간격을 두고 얻은 방사선촬영
소견이 변화가 없다고 하여 NTM 폐질환이 아니라고 할 수는 없다. NTM 폐질환의 진단이 지연되는 경우는
흔히 발생하며, 방사선학적 소견의 변화가 수년이 지난 후에 발견되는 경우도 많다. 폐조직 검사를 시행하지
않는 상황에서 객담에서 분리된 NTM의 임상적 의의를 정확히 평가하기 위해서는 수년 이상의 임상적, 방사선학적,
미생물학적 추적관찰이 필요할 수도 있다. 이는 특히 발병력이 상대적으로 큰 M. kansasii , M. avium complex,
M. abscessus complex 등이 분리되었을 때 더욱 그러하다.


결핵균을 발견하기 위해 사용하는 항산균 도말검사와 배양검사는 대부분의 NTM에 그대로 적용할 수 있다.
항산균 도말검사에서 현미경으로 관찰된 NTM의 모양은 결핵균과 구별이 되지 않는다. NTM 폐질환의 빈도가
상대적으로 높은 국가에서는 객담 항산균 도말검사에서 양성을 보인 경우에는 결핵균 핵산증폭검사를 시행하여
이 검사에서 양성을 보일 때는 폐결핵으로 진단하고, 음성을 보일 때는 NTM에 감염된 것으로 잠정 진단 후
최종 진단은 배양결과를 가지고 판단하도록 권장하고 있다. 국내에서도 최근에는 항산균 도말 양성 객담에서
NTM이 분리되는 비율이 계속 증가하고 있어, 객담 항산균 도말 양성 환자에서 NTM 폐질환의 가능성을 항상
고려해야 하며, 폐결핵이 의심되는 환자에서 객담 항산균 도말 및 배양검사와 함께 결핵균 핵산증폭검사를
시행하여야 한다.
NTM의 배양을 위해서는 결핵균 배양에 사용하는 배지를 사용한다. 액체배지는 고체배지에 비해 배양까지의
시간을 단축하고, 더 많은 종류의 NTM을 분리할 수 있다. 국내에서 항산균 배양 양성 중 NTM 비율이 증가하고
있어 배양된 항산균이 결핵균인지 NTM인지 구별해야 한다. NTM으로 확인된 경우에 임상적으로 중요한 경우
동정 검사를 시행해야 하며, 이에 대비하여 배양된 균주를 6개월간 보관한다.
과거에는 고체배지에 자란 균집락의 형태를 관찰하거나 생화학적 성상을 이용하여 균동정을 하였으나, 최근에는
DNA 표지자, 중합효소연쇄반응-제한절편길이 다형성(polymerase chain reaction-restriction fragment
length polymorphism analysis) 등 분자생물학적 검사법을 이용하여 보다 빠른 균 동정을 하고 있다.
약제감수성검사를 시행하는 약제는 원인균에 따라 다르다. M. avium complex는 클라리스로마이신
(clarithromycin)에 대해 검사를 시행한다. M. abscessus complex 등 신속성장형 균은 아미카신(amikacin),
세폭시틴(cefoxitin), 시프로폴록사신(ciprofloxacin), 클라리스로마이신, 독시사이클린(doxycycline), 이미
페넴(imipenem), 리네졸리드(linezolid), 목시플록사신(moxifloxacin), 트리메토프림-설파메톡사졸(trimethoprimsulfamethoxazole),
토브라마이신(tobramycin) 등에 대해 검사를 시행한다. M. kansasii는 리팜핀(rifampin)에
대해 검사를 시행한다. 국내에서는 현재 결핵연구원에서 동정된 NTM에 대한 약제감수성검사를 시행하고 있다.

M. avium complex는 전세계적으로 NTM 폐질환의 가장 흔한 원인균이다. M. avium과 M. intracellulare
두 가지 균종이 M. avium complex에 속한다. 미생물학의 발전으로 M. chimaera, M. yongonense 등 M.
intracellulare와 가까운 균종이 새로운 종으로 구분되고 있지만 아직까지 국내에서 분리되는 비율은 낮다.
M. avium complex 폐질환의 증상과 징후는 비특이적인 경우가 많다. 또한 질환의 경과를 예측하기 힘들다.
일부 환자에서는 병의 진행경과가 빠르고, 일부 환자에서는 수년 동안 임상적으로 방사선학적으로 비교적 안정된
상태를 유지하기도 한다. 이러한 차이는 M. avium complex 폐질환이 두 가지 서로 다른 임상적 형태로 나타나기
때문이다.
M. avium complex 폐질환은 “섬유공동형(fibrocavitary form)”과 “결절 기관지확장증형(nodular
bronchiectatic form)”이라는 서로 다른 두 가지 임상상을 갖는다. 섬유공동형은 과거부터 잘 알려져 왔던
질환으로 주로 오랜 기간의 흡연력과 음주력이 있는 중년 이상의 남성에서 주로 발생하고, 만성폐쇄성폐질환,
기존의 폐결핵 등 기저질환을 대부분 갖고 있다. 흉부X선검사에서는 상엽의 공동이 관찰되는데 폐결핵과 매우
유사한 형태를 갖는다. 림프절 비대와 흉수는 드물다. 이러한 형태의 M. avium complex 폐질환은 치료를
하지 않으면 1-2년 이내에 광범위한 폐 실질의 파괴와 사망으로 진행한다.
M. avium complex 폐질환의 두 번째 형태는 결절 기관지확장증형으로 이는 1980년대 후반에서야 알려진
질병이다. 이는 중년 이상의 비흡연자 여성에서 주로 호발하며, 특징적으로 기저질환이 발견되지 않는다. 단순
흉부방사선촬영에서 상엽의 공동은 관찰되지 않고, 주로 우중엽과 좌상엽의 설상엽(lingular segment)을 침범
하며 폐 양측 하부에 결절과 침윤을 보인다. 고해상도 전산화단층촬영에서 특징적인 방사선학적 소견이 발견
되는데 그것은 기관지확장증에 동반된 다발성 중심소엽성 결절(centrilobular nodule)이다. 이러한 방사선학적
병변은 병리학적으로 기관지주위의 광범위한 육아종성 병변을 나타내는 것이다. 이러한 형태의 M. avium
complex 폐질환을 결절 기관지확장증형이라고 하며, 최근 미국과 일본 그리고 국내에서는 전체 M. avium
complex 폐질환의 다수를 차지하고 있다. 결절 기관지확장증형의 M. avium complex 폐질환은 섬유공동형에
비해 진행속도가 매우 느려서, 일부 환자에서는 흉부X선검사에서 방사선학적 소견의 변화가 수년에 걸쳐 서서히
나타나기도 한다. 따라서 임상적, 방사선학적 변화를 관찰하기 위해서 5-10년 정도의 장기간의 추적관찰이 필
요하기도 하다.
치료를 시작하기로 결정한 M. avium complex 폐질환 환자는 클라리스로마이신 혹은 아지스로마이신
(azithromycin) 등 마크로라이드(macrolide) 계열의 항생제를 포함한 병합 항생제를 투여한다. 1990년 이후
클라리스로마이신, 아지스로마이신 등 새로운 마크로라이드 항생제가 M. avium complex 폐질환 환자의 치료에
도입되면서 치료성적이 향상되었다. 2007년 미국흉부학회와 미국감염학회에서 발표한 치료지침에서는 환자의
개별 상태에 따로 치료약제 선택을 달리 할 것을 권장하였다. 결절 기관지확장증형의 대부분의 환자에서는 (1)
클라리스로마이신 1,000mg 혹은 아지스로마이신 500-600mg, (2) 에탐부톨 25mg/kg 그리고 (3) 리팜핀
600mg을 1주일에 3회 투여하는 간헐치료를 권장한다. 섬유공동형 그리고 심한 결절 기관지확장증형의 환자는
(1) 클라리스로마이신 1,000mg 1일 1회(또는 500mg 1일 2회) 혹은 아지스로마이신 250mg, (2) 에탐부톨
15mg/kg 그리고 (3) 리팜핀 10mg/kg (최대 600mg)을 매일 투여하는 매일치료를 권장한다. 보다 심하고
광범위한 병변을 가진 환자, 특히 섬유공동형의 환자는 초기 2-3개월간 아미카신 혹은 스트렙토마이신 투여를
고려해야 한다.
불행하게도 고령의 M. avium complex 폐질환 환자는 일일 1,000mg의 클라리스로마이신 장기 치료에서
부작용을 흔히 경험한다. 입맛의 악화, 소화기계 부작용, 알레르기 부작용 등이 발생할 수 있다. 따라서 체중이
적거나 70세 이상의 고령인 환자는 클라리스로마이신 250mg을 1일 2회 투여하는 것이 부작용이 적고 환자가
보다 잘 견딜 수 있다. 하지만 클라리스로마이신 용량을 일일 500mg으로 낮추어 투여하면 일일 1,000mg
투여하는 것과 비교하여 치료성적이 낮아질 수 있다.
리팜핀은 간대사를 항진시켜 다른 약물의 대사에 영향을 미친다. 대부분의 M. avium complex 폐질환 환자는
고령이고 동반된 질환으로 인해 리팜핀에 영향을 받는 다른 약물을 함께 복용하는 경우가 많아 주의를 요한다.
에탐부톨의 가장 큰 부작용은 시신경 장애이다. 결핵치료에서 에탐부톨을 15mg/kg 용량으로 사용할 경우
시신경염의 발생은 낮다고 알려져 있다. 폐결핵과 달리 M. avium complex 폐질환은 신장기능이 저하된 고령의
환자에서 발생하며, 다른 안과질환을 가질 위험이 크며, 에탐부톨을 장기간 사용한다는 점에서 시신경염의 발생
위험이 높다. 스트렙토마이신은 근육주사라는 불편함뿐 아니라 고령의 환자에서 신장기능의 저하, 청신경 장애를
초래할 수 있다.
이러한 여러 약제부작용으로 인하여 현재까지 보고된 연구결과에 의하면 항생제 치료를 시작한 환자 중 20%
이상의 환자가 중도에 해당 약제를 중단하거나 치료를 중단하게 된다. 따라서 환자를 담당하는 의사는 장기간의
항생제 치료에 따른 부작용의 발생 가능성을 주지하고 이의 예방과 발생시 조치에 주의를 하여야 한다. 항생제
치료에 실패하거나 부작용 등으로 항생제 치료를 계속하지 못하면서 병변이 국한되어 있고 적절한 폐기능을
가진 환자에서 폐절제술이 시행될 수 있다.

신속성장형 NTM에 의한 폐질환은 대부분 M. abscessus complex에 의해 발생한다. M. abscessus complex
폐질환은 중년 이상의 비흡연자 여성에서 흔히 발생한다. 증상은 기침, 발열, 객혈, 객담 등이 흔히 동반된다.
흉부X선검사에서 흔히 관찰되는 소견은 양측성 간질성, 결절성 음영이며, 공동은 일부의 환자에서 발견된다.
전산화단층촬영에서는 양측성 기관지확장증과 다발성의 소결절, 폐실질의 경화, 기관지벽의 비후 등이 관찰되어
M. avium complex 폐질환의 결절 기관지확장증형과 유사한 소견을 보인다. 흥미롭게도 M. abscessus
complex 폐질환 환자의 15%는 과거 M. avium complex 폐질환의 병력이 있거나 경과 도중 M. avium
complex가 객담에서 분리된다. 반대로 결절 기관지확장증형의 M. avium complex 폐질환 환자의 30%는
경과 도중 M. abscessus complex가 분리된다. 결절 기관지확장증형의 M. avium complex 폐질환과 M.
abscessus complex 폐질환 환자는 중년 이상의 흡연을 하지 않는 여성에서 흔히 발생하고 기저질환이 없다는
점 등 임상적 특징과 기관지확장증과 동반된 다발성 결절이라는 방사선학적 특징 그리고 일부 환자에서는 M.
avium complex와 M. abscessus complex가 함께 분리된다는 미생물학적 특징 때문에 일부의 환자에서는
현재까지 밝혀지지 않은 공통된 면역기능의 이상이 M. avium complex 또는 M. abscessus complex 폐질환을
일으키지 않을까 관심을 모으고 있다.
M. abscessus complex는 일반적인 항결핵제에 모두 내성을 보인다. 항생제 치료를 받지 않은 환자에서
분리된 M. abscessus complex는 약제감수성검사에서 아미카신, 세폭시틴 등에 감수성을 보인다.
미국흉부학회와 미국감염학회는 2007년 진료지침에서 클라리스로마이신 1일 1,000mg 혹은 아지스로마이신
1일 250mg을 아미카신, 세폭시틴, 이미페넴 등의 정주용 항생제와 함께 사용할 것을 권장하고 있다. 치료초기
수주에서 수개월간 정주용 항생제 2가지를 사용하며 아미카신과 함께 세폭시틴 또는 이미페넴을 사용한다.
최근에는 타이제사이클린(tigecycline)이 치료에 이용되고 있다.
아미카신과 세폭시틴 등 정주용 항생제를 수주에서 수개월 병합치료하면 임상적, 방사선학적 호전을 보인다.
하지만 비용과 합병증 등의 문제로 이러한 정주용 항생제 치료를 장기간 지속하기는 힘들다. M. abscessus
complex 폐질환에 대해 어떤 항생제를 조합하여 어느 기간만큼 치료해야 하는 것이 좋은지 아직까지 확립되지
않았다.
미생물학의 발전으로 최근 M. abscessus complex는 M. abscessus subspecies absessus (이하 M. abscessus),
M. abscessus subspecies massiliense (이하 M. massiliense), M. abscessus subspecies bolletii (이하 M. bolletii)
라는 3가지 다른 세부균종으로 이루어져 있다는 것이 밝혀졌고, 이를 합쳐 M. abscessus complex라고 한다.
각 균종의 분포는 나라에 따라 다르며, 국내에서는 M. abscessus와 M. massiliense가 각각 50% 내외를 차지하며,
M. bolletii는 1-2% 정도로 매우 드물다. M. abscessus는 마크로라이드 항생제에 대한 유도내성(inducible
resistance)을 가지고 있고, M. massiliense는 이러한 마크로라이드 항생제에 대한 유도내성이 없다는 사실이
밝혀졌지만, 어떻게 치료를 달리해야 할지에 대해서는 아직 밝혀져 있지 않다.
시험관 내 약제감수성검사에서 높은 내성을 보이고, 정주용 항생제를 사용하여야 하며, 장기간의 치료기간이
필요하다는 점 등 때문에 M. abscessus 폐질환의 치료는 매우 어렵다. 또한 정주용 항생제를 포함한 치료를
하더라도 내과적 치료만으로 객담 균음전을 이루기는 매우 어려워 병변이 국한된 경우는 폐절제술을 고려해야
한다. 많은 환자에서 질병이 서서히 진행하기 때문에 일부 환자는 치료를 유보하기도 한다. 예를 들어 증상이
심하지 않고 공동이 없는 고령의 환자에서는 진단 후 바로 치료를 시작하는 것보다 폐질환의 진행이 심해지는
시점까지 환자를 치료 없이 관찰하는 것이 더 권장되기도 한다.

다른 NTM과 달리 M. kansasii는 토양이나 하천 등 자연환경에서는 분리되지 않고 도시의 상수도 시스템에서
발견되며, M. kansasii 폐질환은 주로 도시 거주민에서 발생한다.
M. kansasii 폐질환은 임상상과 방사선학적 소견이 폐결핵과 매우 유사하다고 알려져 왔다. 중년 이상의
남성에서 주로 발생하며, 50% 이상의 환자에서 흡연력과 만성폐쇄성폐질환 등의 기저질환이 동반되어 있다.
90% 이상의 환자에서 상엽에 공동이 동반된다. 공동의 벽이 폐결핵에 비해 얇고, 주위 폐실질의 침윤이 덜하다고
하지만 이러한 소견을 개별 환자에서 감별진단에 사용할 수는 없다. 최근에는 M. avium complex 폐질환 또는
M. abscessus complex 폐질환과 같이 결절 기관지확장증 형태의 M. kansasii 폐질환도 증가하고 있다.
M. kansasii 폐질환의 치료는 이소니아지드(300mg), 리팜핀(600mg; 체중 50kg 미만일 때는 450mg),
에탐부톨(15mg/kg)을 매일 투여하며, 이소니아지드 대신 마크로라이드 항생제를 사용하여 M. avium
complex 폐질환과 같이 치료하기도 한다. 치료기간은 최소한 12개월 동안의 배양음전기간을 포함하여야 한다.

WHO의 「결핵 연례보고서 2019 (Global Tuberculosis Report 2019)」에 따르면, 결핵퇴치를 위한 각국의
노력으로 결핵발생률은 2010년 이후 매년 1.6%씩 감소하고 있다. 하지만, 결핵은 여전히 전 세계 10대 사망원인
중 하나로 2018년 약 150만 명(인구 10만 명당 20명)이 사망했고, 약 1,000만 명(인구 10만 명당 130명)이
결핵을 앓고 있다.
우리나라는 2018년 OECD 36개 회원국 중 결핵 발생률(인구 10만 명당 66명)은 1위, 결핵 사망률(인구
10만 명당 4.8명)은 리투아니아(인구 10만 명당 5.6명)에 이어 2위를 기록하였다.


보통 결핵감염 여부는 투베르쿨린검사로 진단하는데 비씨지 접종을 받은 사람은 투베르쿨린 피부반응검사에
서 위양성(false positive)을 보일 수 있으므로 결핵감염률 조사는 비씨지 미접종자들을 대상으로 한다. 그런데
우리나라의 경우 최근 비씨지 접종률이 95% 이상으로 조사대상자를 선정하기가 쉽지 않고 대표성도 떨어지기
때문에 결핵감염률을 조사하기가 어렵게 되었다. 전 인구의 결핵감염률은 1990년 조사에서는 59%였으며
1995년에는 0-29세 연령층의 감염률이 15.5%로 나타났다.
2016년에는 국민건강영양조사 대상 중 표본 2,051명을 추출하여 투베르쿨린 피부반응검사를 통해 결핵
감염률 조사를 실시하였으며, 잠복결핵감염률은 33.2%에 달했다. 연령별로는 40대 46.1%, 50대 48.7%, 60대
45.0%로 40대 이상의 감염률이 매우 높았으며, 10대 6.5%, 20대 10.9% 등 저연령층의 감염률은 상대적으로
낮았다(표 2).


2019년 결핵 신환자는 23,821명(인구 10만 명당 46.4명)으로 전년(26,433명, 인구 10만 명당 51.5명) 대비
2,612명(9.9%) 감소하였다. 이는 2011년 이후 8년 연속 감소이며 최근 10년 간 전년 대비 최대 폭으로 줄어든
것이다(표 3).

결핵 종류별 결핵 신환자 신고현황을 살펴보면(표 3), 2019년 23,821명(인구 10만 명당 46.4명)의 신환자 중
폐결핵 환자는 18,765명(인구 10만 명당 36.6명)으로 78.8%를 차지하였으며, 전년(20,883명) 대비 2,118명
(10.2%) 감소하였다. 도말양성 폐결핵 환자는 6,497명(인구 10만 명당 12.7명)으로 전년(7,330명) 대비 833명
(11.4%) 감소하였다. 폐외 결핵 신환자수는 5,056명(인구 10만 명당 9.8명)으로 21.2%를 차지하였다.

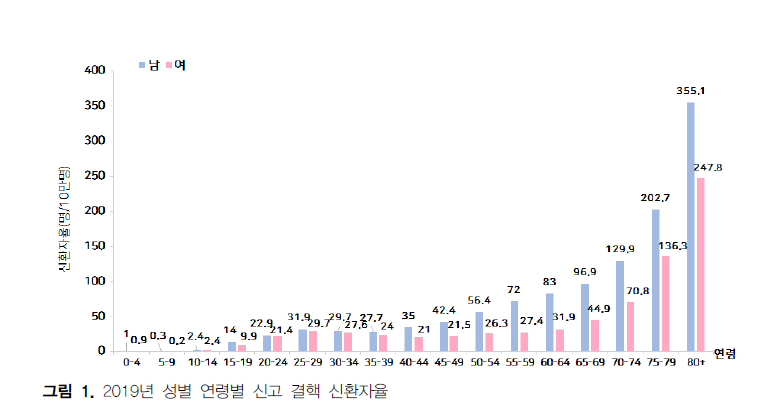
2019년 성별 분포는 남성이 13,847명(인구 10만 명당 54.1명)으로 58.1%, 여성이 9,974명(인구 10만 명당
38.8명)으로 41.9%를 차지하였으며, 신환자율은 남성이 약 1.4배 높게 나타났다(표 5, 그림 1). 연령별 분포는
10-14세를 제외한 모든 연령층에서 감소하였다(표 5). 65세 이상 노년층 11,218명으로 전년 대비 811명
(10.7%) 감소하였으나 전체 신환자의 47.1%를 차지하여 전년(45.5%) 대비 증가하였다(표 6).



2019년 다제내성결핵* 환자수는 580명으로 전년(618명) 대비 38명(6.1%) 감소하였다. 65세 이상 노인의
다제내성결핵환자는 157명으로 전년(172명) 대비 15명(8.7%) 감소했으나, 80세 이상 초고령자의 다제내성
환자수는 68명으로 전년(51명) 대비 17명(33.3%) 증가하였다. 또한 외국인 다제내성결핵환자 수는 107명으로
전년(88명) 대비 19명(21.6%) 증가하였다.
광범위약제내성 결핵** 환자수는 2019년 33명으로 전년(37명) 대비 4명(10.8%) 감소하였다(표 7).
* 다제내성결핵: 이소니아지드, 리팜핀을 포함하는 2개 이상의 항결핵 약제에 내성이 있는 결핵균에 의해
발생한 질병
** 광범위약제내성 결핵: 이소니아지드와 리팜핀에 내성이고 한 가지 이상의 퀴놀론계 약제와 3가지 주사제
(카프레오마이신, 카나마이신, 아미카신) 중 한 가지 이상의 약제에 내성이 있는 결핵균에 의해 발생한 질병



2019년 외국인 결핵 전체환자수는 1,597명으로 전년(1,801명) 대비 204명(11.3%) 감소하였고, 외국인 결핵
신환자수는 1,287명으로 전년(1,398명) 대비 111명(7.9%) 감소하였다(표 8). 이는 국내 외국인 증가로 2016년
부터 결핵고위험국가* 장기체류(91일 이상) 비자신청 외국인 대상 결핵검진을 의무화한 결과다.
2019년 외국인 다제내성결핵환자수는 107명으로 전년(88명) 대비 19명(21.6%) 증가하였다(표 9).
* 결핵고위험국가(19개국): 인도네시아, 베트남, 태국, 필리핀, 스리랑카, 몽골, 네팔, 우즈베키스탄, 파키스탄,
중국, 캄보디아, 방글라데시, 미얀마, 키르키즈스탄, 동티모르, 말레이시아, 러시아, 인도, 라오스


2018년 결핵으로 인한 사망자 수는 1,800명(인구 10만 명당 3.5명)으로 과거에 비해 감소하였으나 여전히
높은 사망자수를 보이고 있다.


국가결핵관리사업(National Tuberculosis Control Program, NTP)이란 정부가 결핵의 역학적 상황 및
국민의 요구에 따라 그 국가의 가용 보건자원 및 기술을 최대한 합리적으로 활용하여 결핵을 퇴치하기 위한
계획적인 보건사업이다.
우리나라 결핵관리는 1962년 국가결핵관리체계를 구축하여 환자 발생이 급감하는 등의 성과를 보였으나,
2000년 이후 결핵환자 감소속도가 둔화되고 다제내성결핵환자가 증가하였다. 또한, 학교나 군부대 등 밀집 시설
등을 중심으로 한 소집단 내에서 결핵이 산발적으로 발생하는 등 OECD 가입국 중 환자 발생률과 사망률이
가장 높게 나타나고 있어 새롭고 강력한 결핵퇴치정책의 도입 필요성이 제기되었다. 이에 2008년 ‘결핵퇴치
2030계획’을 수립하여 체계적인 결핵관리정책의 초석을 다졌고, 2010년 이를 ‘결핵조기퇴치 New 2020 Plan’
으로 수정하였으며, 2013년에는 ‘제1기 결핵관리 종합계획(2013-2017)’을 수립하여 5년간 국가 결핵 예방・관리
목표와 방안을 다각적으로 제시하였다. 아울러, 2016년에는 결핵 사전 발생 예방을 위한 잠복결핵감염 검진사업의
일환으로 ‘결핵 안심국가 실행계획’을 마련하였다. 2018~2019년도에는 결핵 발생률을 선진국 수준으로 낮추기
위해 보다 촘촘하고 구체적인 대책을 담아, ‘제2기 결핵관리종합계획(’18~’22)’을 수립하였다. ‘제2기 결핵관리
종합계획’ 수립 이후 국제사회의 결핵 조기 퇴치를 위한 보다 강화된 전략 추진 결의에 의거하여, 좀 더 강화된
‘결핵예방관리 강화대책(’19.5)’을 수립하였고, 2030년까지 10만명당 10명 수준으로 조기 퇴치를 위한 목표와
중점 추진 방향을 공유 및 제시하였다. 결핵예방 및 조기 발견, 환자 치료 및 접촉자 관리, 결핵연구개발 확대
및 필수자원 관리, 결핵퇴치 대응체계 강화의 4개 전략을 기반으로 노인, 노숙인 등 취약계층 검진강화, 환자
치료 및 관리 강화 등 15개 중점추진과제 및 32개 세부실행관리를 마련하여, 발병 전 선제적인 관리를 통해
결핵 발생을 사전에 차단하고자 한다

결핵퇴치를 위해서는 전염성 결핵환자를 조기 발견하여 치료함으로써 결핵균의 전파를 막고 감염확산을
방지하는 것이 필요하다. 결핵조기퇴치 목표 달성을 위한 결핵환자 발견 사업으로 가족접촉자 검진, 집단시설
결핵역학조사 강화 및 해외 유입 결핵 차단 등 세부사업을 추진하고 있다.

결핵환자의 가족, 동거인 등 밀접접촉자는 결핵감염의 위험이 높으므로 추가 결핵환자 및 잠복결핵감염자를
조기에 발견하여 결핵 발병을 예방하고 전파를 차단하고자 접촉자 조사를 강화하여 실시하고 있다. 사례조사를
통해 결핵환자의 가족 등 접촉자를 확인하고 ‘가족접촉자 검진수첩’을 배부하여 접촉자 검진을 받을 수 있도록
안내하고 있다.

학교, 의료기관, 군부대, 시설, 직장 등 집단시설에서 결핵환자 발생 시 결핵역학조사를 통해 밀접접촉자 중
확인되지 않은 결핵환자 및 잠복결핵감염자를 조기에 발견・치료하여 향후 결핵 발병을 예방하고자 2013년부터
결핵전문역학조사반을 구성・운영하고 있다. 3개 권역(수도권, 중부・호남권, 영남권)에 조사반원을 배치하여 기관
내 결핵발생 시 현장조사, 기술지원(TST검사), 교육지원(시도 및 보건소 담당자 교육), 역학조사 자료구축 등
업무를 수행하고 있다.
역학조사 현황은 2013년 1,142건, 2016년 3,502건, 2019년 4,526건으로 결핵환자 신고 시 직업항목 기재
의무화와 역학조사 실시기준 단계적 확대에 따라 시행건수가 지속적으로 증가추세이다. 결핵역학조사는 결핵
환자가 1인 이상 발생한 시설 중 전염성이 확인된 경우 실시하며, 접촉자조사 대상자에 대해 결핵 및 잠복결핵
감염 검사를 시행하고 환자나 잠복결핵감염자가 있을 경우 치료를 실시하고 있다. 정부는 검사와 치료비용을
지원하고 있다.

해외로부터 유입되는 결핵을 차단하고 국내 결핵 전파를 예방하고자 2016년에 법무부와 협조하여 ‘외국인
결핵관리지침’을 마련하여 외국인 결핵관리를 강화하였다. 결핵고위험국가 외국인이 국내 입국을 위한 장기사증
신청 시 결핵검사를 의무화하여 입국을 제한하였다.
또한 국내에 체류 중인 외국인의 경우, 단기사증에서 장기사증으로 변경하거나 장기 사증 연장 신청한 경우
결핵검사를 의무화하여 체류기간을 제한하였다. 결핵으로 확인된 외국인은 내국인과 동일하게 치료를 지원하고
있으며, 치료에 비순응하면 중점관리대상자로 등록하여 강제 출국 또는 출국 확인 시 재입국을 제한하고 있다.

성공적인 결핵 치료를 위해서는 정확한 진단과 적절한 치료 그리고 환자의 규칙적인 투약 및 지속적 환자
관리가 필요하다. 환자의 체계적인 관리를 위해 환자 상담 및 교육, 환자 치료 및 관리 지원, 전염성결핵환자
(다제내성 및 비순응) 관리 강화, 취약계층 관리 강화, 잠복결핵감염자 관리 등 세부사업을 추진하고 있다.

결핵 치료 성공률 제고 및 치료순응도 향상을 통한 재발률 및 내성결핵의 감소를 위해, 2010년 결핵환자를
산정특례대상자로 선정하여 본인부담금을 10% 부담토록 조정하였고, 2011년부터 공단위탁으로 본인부담금의
절반을 국비로 지원하여 왔다. 2016년 7월부터 결핵환자 치료비 본인부담금 전액을 면제하여 무료로 치료 받을
수 있도록 개선하여 결핵으로 인한 경제적 부담을 해소하였다.
또한, 결핵환자에 대한 내원독려, 복약확인 등 철저히 환자를 관리할 수 있도록 의료기관과 보건소에 결핵관리
전담인력을 배치하여 관리하고 있다.

다제내성결핵 및 치료비순응 결핵환자의 치료순응도 향상을 통해 치료 성공률을 높이고 타인에게 결핵균
전파 차단을 위하여 입원명령을 실시하여 전염성 소실 시까지 입원치료를 받도록 하고 있다. 입원명령 결핵환자에
대해 입원 기간 동안 입원비 및 약제비를 지원하고, 입원명령으로 인한 소득 상실로 생계가 어려운 경우에는
환자 가구의 소득조사를 실시하여 대상자에 한해 부양가족 생계비를 지원하고 있다.
또한, 치료 비순응 결핵환자에 대한 치료 성공률 향상을 위해 지자체와 국・공립병원 및 민간 병・의원 간의
협력체계를 구축하여 전염성결핵환자 관리를 위한 기반·체계를 구축하여 전염성결핵환자(다제내성 및 비순응)
발견・연계・관리 강화를 위해 노력하고 있다.

취약계층 결핵환자의 의료접근성과 치료성공률 향상을 위해 2014년에 ‘결핵안심벨트 지원사업’을 시작하였고,
공공병원 중심의 10개의 협약기관 간 협조체계를 구축하여 저소득 결핵 환자에게 체계적인 서비스를 제공하는
등 제도적 장치를 마련하여 취약계층에 대한 관리를 강화하고 있다.

정부는 2011년부터 본격적으로 질병관리본부 중심의 결핵예방 홍보사업을 추진 중이다.
구체적으로 전 국민을 대상으로 결핵에 대한 경각심 고취 등의 인식개선 및 결핵검사 유도, 기침예절 실천
활성화 등 결핵예방을 위한 행동수칙을 인지시키기 위한 홍보사업이 진행 중이다.
특히, ‘2주 이상 기침하면 결핵검진’이라는 간결하고 명확한 메시지를 매체 광고 및 눈높이 맞춤형 콘텐츠
(인쇄물, 영상, 교육자료 등)를 통해 홍보 중이며, 결핵예방을 위한 가장 기본적 생활수칙인 ‘기침예절 실천 캠페인’을
함께 추진하고 있다.
지난 2019년부터, 국내 결핵 신규환자의 45.5%를 차지하는 ‘65세 이상 어르신’을 결핵예방 홍보사업의 메인
타깃으로 정하고, 어르신의 생활접점(버스・지하철 등 대중매체, 거리 현수막 및 X-배너, 경로당 등)에 옥외 홍보
콘텐츠를 통한 어르신 결핵예방 메시지(65세 이상 어르신 1년 1회 결핵검진) 홍보를 강력하게 추진 중이다.
아울러 결핵예방법(제4조)에 의거하여 3월 24일을 「결핵예방의 날」로 지정하고, 기념행사를 개최하여 결핵
유공자를 발굴하여 표창하고, 이 날을 전・후로 한 일주일간의 ‘결핵예방주간’ 운영을 통해 전국 자치단체 중심의
캠페인 활동이 이어지도록 운영을 강화해 나가고 있다.




'호흡기내과 > 폐결핵' 카테고리의 다른 글
| 잠복결핵감염 진단 방법 (0) | 2020.11.23 |
|---|---|
| 결핵 진료지침 2020 [Ⅶ 소아청소년 결핵] (0) | 2020.06.18 |
| 결핵 진료지침 2020 [IX 환자관리] (0) | 2020.06.18 |
| 결핵 진료지침 2020 [VIII 잠복결핵감염] (0) | 2020.06.18 |
| 결핵 진료지침 2020 [VI 폐외 결핵] (0) | 2020.06.18 |



