조직검사 결과를 확인하다 보면 IHC, FISH에서 각각 ERBB2 (HER2) 3+, ERBB2 (HER2) amplification라는 표현을 보게 됩니다.
ERBB2 (HER2) 3+는 IHC를 이용하여 DNA가 아니라 단백질 수준에서 HER2의 과발현 여부를 평가하는 검사입니다. 이 검사는 고정된 종양 조직(FFPE tissue) 슬라이드에서 HER2 단백질이 세포막에 얼마나 강하게 발현되어 있는지를 염색을 통해 직접 시각적으로 평가합니다. 병리의가 염색 강도와 양성 세포 비율을 기준으로 0부터 3+까지 점수를 매기며, 3+는 HER2 단백질의 강한 과발현을 의미합니다. 이 IHC 평가는 semi-quantitative(반정량적) 방법으로, 단순한 정성 분석이 아닌 일정 수준의 정량적 기준(예: 10% 이상 세포에서 강한 막 염색)을 함께 고려합니다. 혈액은 사용되지 않으며, 반드시 종양 조직을 이용해야 합니다.
ERBB2 (HER2) FISH 검사는 HER2 유전자의 증폭 여부를 DNA 수준에서 직접 시각적으로 확인하는 검사입니다. 이 검사는 형광 탐침(fluorescent probe)을 이용하여 종양 세포 내의 HER2 유전자 부위에 결합시킨 후, 현미경을 통해 HER2 유전자의 copy number를 관찰합니다. 일반적으로 HER2 유전자와 염색체 17번 중심절(CEN17) 신호의 비율(HER2:CEN17 ratio)을 기준으로 증폭 여부를 판정합니다. FISH는 IHC와 달리 단백질 발현을 측정하지 않고, NGS처럼 DNA 수준에서 증폭을 평가하지만, 그 방식은 염기서열 분석이 아닌 형광 시각화 기반의 직접적 정량 방법입니다. 검체는 IHC와 마찬가지로 반드시 고정된 조직(FFPE tissue)에서 얻어야 하며, 혈액(ctDNA) 검사는 불가능합니다. 주로 IHC 결과가 2+로 애매할 때 보조 검사로 사용되며, HER2 gene amplification이 확인되면 HER2 표적 치료의 적응증으로 간주할 수 있습니다.
한편 ERBB2 (HER2) amplification는 NGS를 이용하여 DNA 수준에서 HER2 유전자의 증폭 여부를 평가하는 검사입니다. 이 검사는 ERBB2 유전자의 copy number(복제 수)를 측정하여, 종양 세포가 HER2 유전자를 정상보다 과도하게 증폭(amplification)하고 있는지를 확인합니다. 직접 단백질을 측정하지 않고, 유전자의 수적 증가를 통해 HER2 활성화 가능성을 간접적으로 추정하는 방식입니다. 검체는 주로 고형암의 고정된 조직(Fixed tissue, FFPE)에서 얻어지지만, 최근에는 혈액 기반 액체생검을 통해 얻은 ctDNA(circulating tumor DNA)로도 NGS가 가능해졌습니다. 특히 ctDNA는 침습 없이 암을 모니터링하거나 조직 확보가 어려운 경우에 유용합니다. 그러나 실제 진단이나 치료 결정에서는 여전히 조직 기반 NGS가 가장 널리 사용되고 있습니다.
|
구분
|
NGS (ERBB2 amplification)
|
IHC (ERBB2 3+)
|
|
측정 수준
|
DNA 수준 (유전자 copy number)
|
단백질 수준 (HER2 단백질 발현)
|
|
측정 대상
|
조직 또는 혈액 내 ctDNA (가능)
|
조직(FFPE)만 가능
|
|
검사 목적
|
HER2 유전자 증폭 확인 → 치료 타깃 가능성
|
HER2 단백질 과발현 확인 → 치료 적응증 판단
|
|
기술적 특성
|
정량적, 고해상도 유전자 분석
|
시각적, 반정량적 단백질 염색 평가
|

file:///C:/Users/sjlov/Downloads/jpm-12-01684-v2.pdf
오늘은 차세대 DNA 시퀀싱 [Next-generation DNA sequencing, NGS]: 원리와 임상적 적용에 대해 정리해 보았습니다.
차세대 시퀀싱 [Next-generation sequencing, NGS]은 DNA 시퀀싱 기술의 한 형태로, 여러 개의 작은 DNA 조각을 병렬적으로 시퀀싱하여 염기서열을 결정하는 방식입니다.
전체 유전체를 시퀀싱할 수 있는 능력은 임상의에게 다음과 같은 여러 가지 도전적인 질문을 제기합니다:
- NGS를 임상적으로 고려해야 할 시점은 언제인가?
- 사용 가능한 여러 종류의 유전적 검사 중에서 최선의 선택은 무엇인가?
- 전체 유전체 시퀀싱으로부터 얻어진 결과의 임상적 중요성은 무엇인가?
- 어떤 결과에 대해 조치를 취하거나/또는 환자에게 전달해야 하는가?
용어 및 기술의 발전 [TERMINOLOGY AND EVOLUTION OF TECHNOLOGIES]
다음 용어들은 시퀀싱 방법론을 구분하기 위해 사용됩니다:
1. 생거 시퀀싱 [Sanger sequencing]
생거, 맥삼, 길버트에 의해 개발된 방법을 사용한 수동 또는 자동 시퀀싱은 DNA 시퀀싱 방법의 "1세대"로 간주됩니다. 이러한 시퀀싱은 흔히 "전통적인" 또는 "기존의" 시퀀싱이라고도 불립니다. 생거 시퀀싱은 약 500~900 염기쌍에 이르는 큰 DNA 조각의 염기서열을, DNA 주형에 따라 중합된 서로 다른 길이의 산물을 수집하고 정렬하여 결정합니다. 원래의 생거 방법은 각 뉴클레오타이드에 방사성 마커를 사용하였고, 이후에는 형광표지된 버전이 사용되었습니다.
생거 시퀀싱은 특정 유전자의 염기서열을 검사할 때 임상적으로 사용됩니다. 예를 들어, 전통적인 시퀀싱은 hemophilia B가 의심되는 환자에서 IX 인자의 돌연변이를 확인하는 데 사용할 수 있으며, 이때 환자의 나머지 유전체는 검사하지 않습니다. 이 상황에서는 IX 인자를 암호화하는 유전자의 돌연변이가 질병을 유발하는 것으로 이미 알려져 있고, 돌연변이는 질병의 검사 지표(예: 활성화 부분 트롬보플라스틴 시간 [aPTT])와 연관될 수 있으며, 다른 유전자의 돌연변이가 hemophilia B를 유발할 가능성은 매우 낮기 때문에 생거 시퀀싱이 선호됩니다.
대조적으로, 생거 시퀀싱은 전체 유전체의 많은 부분(예: 여러 유전자)에 대한 정보를 현실적인 비용과 시간 내에 제공하지 못하는 경우가 많습니다. 한 추정에 따르면 생거 시퀀싱을 사용하여 인간 전체 유전체를 시퀀싱하는 데는 60년이 걸릴 것이라고 예측되었습니다.
2. 차세대 시퀀싱 [Next-generation sequencing, NGS]
차세대 시퀀싱은 여러 DNA 조각을 병렬로 시퀀싱하는 방식입니다. 이 기술은 다른 용어로도 불립니다 (예: 단편 시퀀싱 [short-read sequencing], 고처리량 시퀀싱 [high-throughput sequencing], 심층 시퀀싱 [deep sequencing], 2세대 시퀀싱 [second-generation sequencing]). 생거 시퀀싱과 달리, NGS는 시퀀싱 속도와 생성되는 DNA 염기서열 데이터의 양이 기하급수적으로 증가하며, 비용도 크게 감소합니다.
NGS는 여러 유전자의 염기서열을 확인하는 것이 유용하다고 여겨지는 임상 시나리오에서 사용됩니다.
3. 3세대 시퀀싱 [Third-generation sequencing]
3세대 시퀀싱(긴 읽기 시퀀싱 [long-read sequencing]이라고도 함)은 NGS와 유사한 병렬 시퀀싱을 사용하지만, 증폭된 DNA가 아닌 단일 DNA 분자를 주형으로 사용합니다. 따라서 3세대 시퀀싱은 실험실 내 DNA 증폭 과정에서 발생하는 염기서열 오류를 제거할 수 있는 잠재력이 있습니다.
3세대 시퀀싱 기술은 개발 중에 있으며 일반적으로 임상에서 사용 가능하지는 않습니다. 이 접근법의 기술은 NGS에서 사용되는 단편 시퀀싱 기술의 정확도에 근접해가고 있으며, 이는 임상적 NGS의 황금 기준으로 간주됩니다. 3세대 시퀀싱은 유전체 내에서 염기 중 구아닌(G)과 시토신(C)의 비율이 높은 "GC 함량" 영역 등 가장 분석이 어려운 부분을 시퀀싱할 수 있게 하며, 유전체 내 구조적 변이에 대한 더 나은 분석을 제공합니다.
차세대 시퀀싱의 임상적 사용 [CLINICAL USE OF NEXT-GENERATION SEQUENCING]
위험과 이점 [Risks and benefits]
NGS는 항상 가장 적절한 임상 유전 검사인 것은 아닙니다. NGS는 비용이 많이 들고, 시간이 오래 걸리며, 임상 평가를 통해 후보 유전자가 하나 또는 몇 개로 좁혀진 유전 질환을 진단하는 데는 생거 시퀀싱 [Sanger sequencing]이나 다른 보다 전통적인 유전 결함 탐지 방법이 더 적합한 경우가 많습니다.
그러나 병원성 유전자가 다수 존재하여 이를 선별해야 하는 경우에는 엑솜 시퀀싱 [exome sequencing]이나 표적 NGS 유전자 패널 [targeted NGS gene panels]을 고려하는 것이 적절합니다. 마찬가지로, 한 질환이 가족 내에서 높은 유전력을 보이거나 유전적 기반이 의심되지만 가능한 후보 유전자의 수가 많거나 원인 유전자가 알려져 있지 않은 경우에는 엑솜 시퀀싱이나 전장 유전체 시퀀싱 [whole genome sequencing]을 고려해야 합니다.
NGS의 잠재적 이점은 100,000 유전체 프로젝트 [100,000 genomes project]에서 입증되었습니다. 이 프로젝트에서는 진단되지 않은 상태의 개인 4,660명(프로반드 2,183명과 영향을 받은 가족 구성원 및 영향을 받지 않은 가족 구성원 2,477명)의 전체 유전체를 시퀀싱하였습니다.
이 연구를 통해 얻어진 주요 이점은 다음과 같습니다: 수년, 혹은 수십 년 동안 원인을 찾지 못했던 진단의 방황(diagnostic odyssey)을 끝낼 수 있었고, 새로운 연구 대상 및 약물 개발을 위한 유전자 표적이 발견되었으며, 나아가 환자의 1차 친족, 특히 자녀에게도 유전성 여부를 확인할 수 있는 기회를 제공하게 되었습니다.
암 검진 및 치료 [Cancer screening and management]
많은 종류의 암에서, 검진, 진단 검사, 치료 선택은 다음의 유전체 정보를 포함합니다:
종양에 대한 유전체 정보(체세포 변화 [somatic changes]), 유전된 암 관련 유전자들(예: BRCA1 및 BRCA2)의 생식세포 변이 [germline changes], 그리고 유전 조절인자 [genetic modifiers]의 생식세포 변이입니다. 표적 유전자 패널 [targeted gene panels]은 다양한 암 유형, 특히 둘 이상의 유전적 변이가 원인이 될 수 있는 경우에서 활용도가 증가하고 있음을 보여주고 있습니다.
미국유방외과학회 [American Society of Breast Surgeons]는 2019년 2월에 발표한 가이드라인을 통해, 유방암이 진단된 환자라면 누구든지 BRCA1, BRCA2, 그리고 PALB2 유전자가 포함된 다유전자 생식세포 검사 [multigene germline testing]를 받는 것이 바람직하다고 권고했습니다. 이 권고는 기존 NCCN 지침이 유방암과 관련된 병원성 유전자 변이를 가진 환자를 충분히 걸러내지 못한다는 연구결과를 근거로 삼았습니다.
임상적으로 사용되는 주요 암 유전자 패널의 예는 다음과 같습니다:
- 유방암이나 난소암 병력이 없더라도 전립선암 및/또는 췌장암의 개인 또는 가족력이 있는 경우, BRCA1 및 BRCA2를 포함한 암 유전자 패널 사용. 유방암 위험 증가와 관련된 다른 유전자로는 ATM, CDH1, CHEK2, NF1, PALB2, TP53 등이 있습니다.
- 위장관암의 유전적 원인을 확인하기 위한 패널(예: APC, BMPR1A, EPCAM, MLH1, MSH2, MSH6, MUTYH, PMS2, PTEN, SMAD4, STK11, TP53, BLM, CHEK2, GALNT12, GREM1, POLD1, POLE 포함)
- 가족성 급성 백혈병 증후군 [familial acute leukemia syndromes]의 확인
- 급성 골수성 백혈병 [acute myeloid leukemia]의 예후군 분류
- 특 유전성 골수 부전 증후군 [inherited bone marrow failure syndromes] 분류 (예: 이소성 망상세포형성이상 [Dyskeratosis congenita] 포함한 텔로미어 생물학 질환)
- 종양 조직 또는 비종양 조직 분석을 통해 생식세포 또는 종양에 존재할 수 있는 유전적 이상 확인 – 분자 표적 치료 [molecularly targeted therapies]와 매칭될 수 있음. 예: BRCA1 또는 BRCA2 돌연변이가 확인된 환자에게는 PARP 억제제 [poly(ADP-ribose) polymerase inhibitor] 사용 가능.
2017년, 미국 식품의약국(FDA)은 암 유전자 검사의 일종인 두 가지 유전자 패널 검사를 공식 승인했습니다. 이 두 검사는 MSK-IMPACT와 F1CDx라는 이름을 가지고 있으며, 몸 어디에서 시작되었든 관계없이 암 조직에서 유전자의 이상 여부를 확인할 수 있는 검사입니다. 이 검사는 수술이나 조직검사로 얻은 암 조직을 특수 방식(포르말린으로 고정하고 파라핀에 넣는 방법)으로 처리한 경우에도 사용할 수 있습니다. 즉, 병리검사에 쓰이는 일반적인 조직 샘플에서도 검사가 가능하다는 뜻입니다.
MSK-IMPACT는 400개가 넘는 유전자의 이상을, F1CDx는 300개가 넘는 유전자의 이상을 한 번에 확인할 수 있습니다. 또한 이 검사들은 단순히 유전자 하나하나만 보는 것이 아니라, 암세포와 정상세포의 차이, DNA 복제 중 오류가 자주 일어나는 마이크로위성 불안정성(microsatellite instability), 종양이 가지고 있는 유전자 변이의 양(돌연변이 부담 [tumor mutational burden]) 같은 정보를 함께 제공합니다. 이런 정보는 환자에게 맞춤형 치료를 선택하는 데 큰 도움이 됩니다. 특히 F1CDx는 유전체 정보에 기반해 치료 방향을 정할 수 있는 여러 종류의 암, 그리고 어디서 시작됐는지 정확히 알 수 없는 암에서도 사용될 수 있습니다.
2017년, 단클론 항체 펨브롤리주맙 [pembrolizumab]은 절제 불가능하거나 전이된 고형 종양 중 MSI-high(MSI-H) 또는 MMR 결함(dMMR)이 있는 성인 및 소아 환자 치료에 대해 FDA 승인을 받았습니다. 이는 치료제가 최초로 암의 해부학적 위치와 무관하게 승인된 사례로 의미가 큽니다.
종양 유전학에서 이용 가능한 다른 유전자 검사는 유전자 염기서열이 아닌 유전자 발현 [gene expression]을 사용하여 분자 서명을 식별합니다. (예: 유방암 및 전립선암의 Oncotype Dx 패널) 유전자 발현 분석은 유전자 전사가 어느 정도 이루어졌는지를 측정하며, 이는 염기서열 변이 분석과 다릅니다.
문제
62세 여자가 좌측 유방의 덩어리를 주소로 병원에 내원하였다. 환자는 최근 3개월간 덩어리가 점차 커졌다고 하며 통증은 없다. 유방촬영술과 유방 초음파에서 좌측 유방 상외측에 경계가 불규칙한 2.5cm 크기의 고형 종괴가 확인되었고, 초음파 유도 조직검사에서 침윤성 유관암(invasive ductal carcinoma)으로 진단되었다. 수술 전 항암 치료(Neoadjuvant chemotherapy)를 고려하여 유전자 이상을 확인하고자 혈액 기반의 차세대 시퀀싱(ctDNA 기반 NGS)을 시행하였다. 검사 결과, ERBB2(HER2) 유전자의 copy number 증가가 확인되었다. 이 결과를 해석하고 치료 방침을 결정하기 위한 다음 단계로 가장 적절한 것은?
① 혈액 기반 NGS에서 확인된 HER2 유전자 증폭을 근거로 곧바로 trastuzumab 치료를 시작한다.
② 혈액 기반 NGS 결과만으로 HER2 단백질 과발현이라 단정하고 FISH 검사는 생략한다.
③ 조직생검 시 확보된 조직에서 IHC 또는 FISH 검사를 시행하여 HER2 증폭/과발현 여부를 확정한다.
④ 혈액 기반 NGS에서 관찰된 HER2 amplification은 유방암 치료 적응증과 무관하므로 무시한다.
정답: ③ HER2 증폭 여부를 조직 기반의 검사(IHC 또는 FISH)를 통해 추가로 확인한다
해설 : ERBB2(HER2) 유전자는 유방암에서 중요한 분자 표지자로, 유전자 증폭(amplification) 또는 단백질 과발현(overexpression)이 있을 경우 trastuzumab, pertuzumab, T-DM1, T-DXd 등 다양한 HER2 표적 치료제의 적응증이 될 수 있다.
이 사례에서 시행된 ctDNA 기반 NGS 검사는 혈액 내 순환 종양 DNA를 분석하여 HER2 유전자의 copy number 증가를 보고하였다. 이는 HER2 amplification 가능성을 간접적으로 시사하는 분자 수준의 정보이지만, 단백질 과발현 여부를 직접 확인하지 않으며, 치료 적응증 확정에는 부족하다.
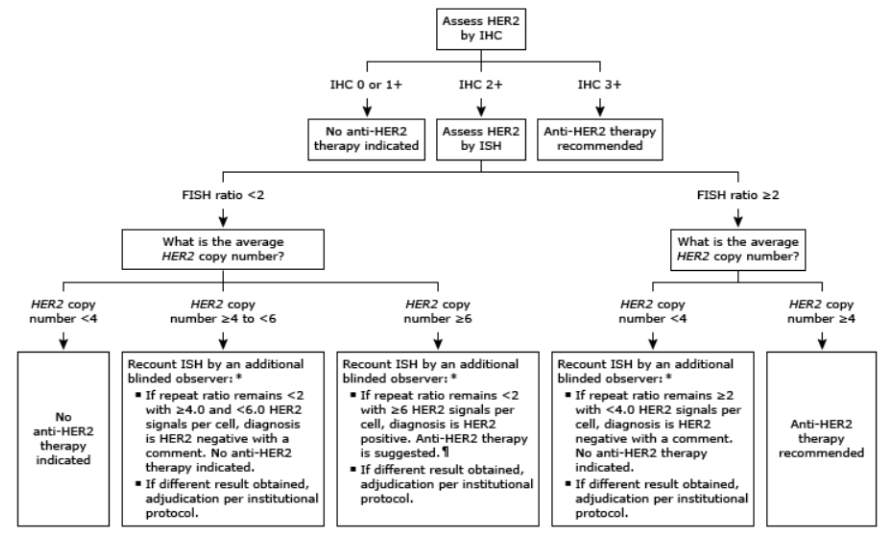
현재(2025년 기준), HER2 표적 치료의 적응증은 조직 기반 검사에서 다음 중 하나를 만족해야 한다: IHC 검사에서 3+ (세포막 강한 완전 염색), IHC 2+ + FISH 양성 (유전자 copy 수 증가). 즉, 혈액 기반 ctDNA NGS 결과만으로는 치료 시작을 결정할 수 없으며, 조직 기반의 IHC 또는 FISH 검사를 추가로 시행하여 HER2 상태를 확정하는 것이 필수적이다.
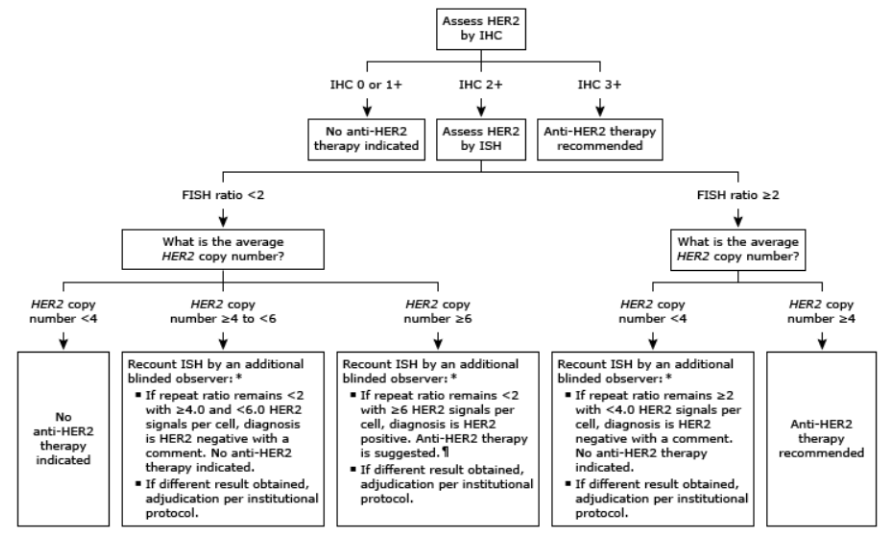
|
Patients are eligible for adjuvant HER2-directed treatment if they have HER2-positive breast cancer defined as:
|
① NGS에서 확인된 것은 돌연변이(mutation)이 아닌 amplification이며, 치료 개시 기준은 아님 ② 단백질 과발현을 직접 평가한 것이 아니므로 잘못된 진술 ③ 조직 기반 검사(IHC 또는 FISH)를 통해 HER2 상태를 확정해야 함 ④ HER2 amplification은 유방암에서 치료와 매우 밀접한 관련이 있음 (전혀 무관하지 않음)
참고문헌 : UpToDate 2025.05.09
'종양내과 > 서론' 카테고리의 다른 글
| 면역관문억제제, 면역항암제 키투르다, 옵디보, 젬퍼리, 테센트리크, 임핀지, 바벤시오, 리브타요 (2) | 2023.06.06 |
|---|---|
| 국가 가이드라인과 달리 많은 미국 암센터는 PSA를 통한 보편적인 검사를 권고한다. (0) | 2023.01.24 |
| 면역관문억제제 작용 기전, Checkpoint inhibitor immunotherapy, mechanism (0) | 2022.07.09 |
| 전이성 비소세포폐암 (Metastatic NSCLC), EGFR TKI (0) | 2022.06.20 |
| PSA 농도와 체중과의 관련성, Weight effects on normal range (0) | 2020.08.10 |



