

PD-1 Inhibitor인 dostarlimab은 MSI-High Locally Advanced Rectal Cancer에서 효과적이었습니다. 작은 규모의 phase 2 trial에서 dostarlimab으로 치료받은 모든 환자들은 comple clinical response에 도달했습니다.
직장암의 표준 치료 방식은 수술 전 항암방사선 치료 후 수술과 수술 후 항암치료였으나 neoadjuvant therapy로 대체되고 있습니다. Microsatellite instability (MSI)-high rectal cancers는 직장암의 드문 유형으로서 immune checkpoint inhibitors에 높은 반응률을 보입니다.
이 연구는 단일 기관, phase 2 trial이며 anti–PD-1 agent인 dostarlimab을 locally advanced rectal cancer의 1차 치료제로 사용하였습니다. DNA mismatch repair protein–deficient rectal cancer 환자들에게 6개월 동안 3주 간격으로 dostarlimab (500 mg)을 투약하였습니다. 단계 평가와 추적 검사는 DRE, 내시경, rectal MR, PET scan, CT scan으로 하였습니다.
16명 환자들이 등록되었고 중간값 나이는 54세, 여자는 63%, 대부분 T3 (56%)였으며 node positive는 94%였습니다. 14명 중에 57%는 germline DNA mismatch repair protein deficiency가 있었습니다. 중간값 추적 기간은 12개월이었습니다. 치료를 완료하였고 적어도 6개월 추적 관찰을 한 12명 환자들 중에서 모든 환자들에 clinical complete response에 도달하였고 항암, 방사선, 수술 치료를 필요로 하지 않았습니다.
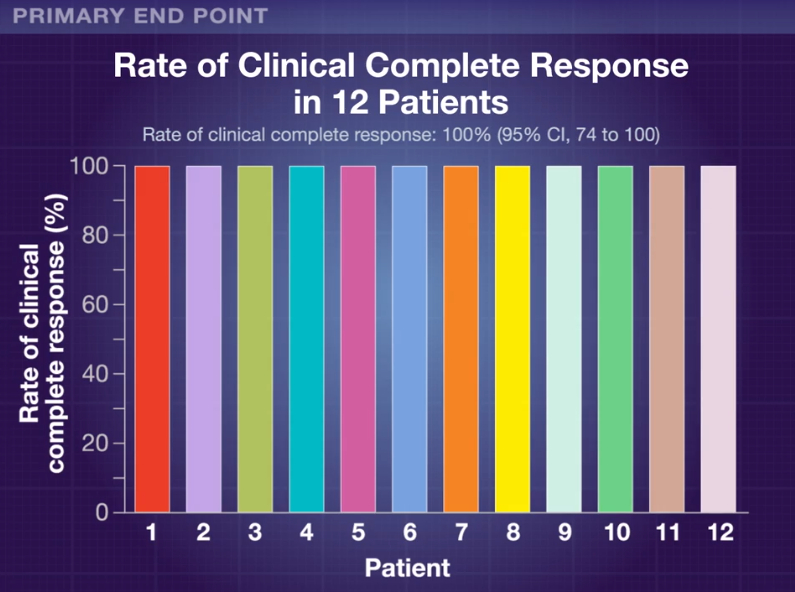
This landmark study indicates that primary treatment of MSI-high rectal cancer with the anti–PD-1 agent dostarlimab achieved a 100% rate of potentially durable clinical complete response without use of chemotherapy, radiation, or surgery. Arguably, immune checkpoint inhibitor therapy may become the primary treatment of choice for locally advanced MSI-high rectal cancer, with reservation of chemoradiotherapy and surgery for nonresponding patients.
이 논문에서 언급된 dostarlimab은 tissue-agnostic cancer therapy에서 언급되는 anti-programmed cell death 1 (PD-1)-based immune checkpoint inhibitor immunotherapy로서 첫 약제는 pembrolizumab이었습니다. 이 약제는 2017.5월 US FDA 승인을 받았으며 암종과 무관하게 high levels of microsatellite instability (MSI-H)와 deficient mismatch repair (dMMR) cancer에 효과적입니다.
Dostarlimab은 처음에 MMR-deficient advanced endometrial cancer 치료를 위해 승인되었던 약제이지만 2021.08월 US FDA는 dostarlimab을 모든 재발성 dMMR solid tumor에 사용을 승인하였습니다.
Ref. N Engl J Med 2022;386:2363-76.
Uptodate 2022.07.03
'소화기내과(위장관) > 암, 악성종양' 카테고리의 다른 글
| 위암의 개괄, Gastric cancer (0) | 2023.09.12 |
|---|---|
| 관례적 검사 권유 (0) | 2020.11.19 |
| Neuroendocrine neoplasms의 grading 평가 (mitotic activity, Ki-67 labeling index) (0) | 2020.08.26 |
| Lynch syndrome에서 microsatellite instability (MSI), mismatch repair (MMR) genes이란? (0) | 2020.08.24 |
| 이소성 췌장, Pancreatic rest, ectopic pancreas, aberrant pancreas, heterotopic pancreas (0) | 2020.07.25 |



