▶ 블로그 글 정리 순서
1. 진행성 비소세포폐암에 대한 개별환된 유전자-표적 치료 개요
2. 진행성 비소세포폐암의 초기 치료 개요
3. 진행성 비소세포폐암 치료에서 EGFR에 activating mutation이 있는 경우
4. 타그리소정 (오시머티닙)

전이성 비소세포폐암 (metastatic non-small cell lung cancer (NSCLC)) 환자의 치료는 역사적으로 전신 세포독성 화학요법 (systemic cytotoxic chemotherapy)으로 이루어졌습니다. 화학 요법은 성장하거나 분열하는 세포를 죽이는 일반적인 목표를 가지고 있습니다. 화학 요법은 증상을 감소시키고 삶의 질을 향상시키며 일부 NSCLC 환자의 생존을 연장합니다.
비소세포폐암 및 기타 신생물에서 악성을 유발하는 분자 경로 (molecular pathways)에 대한 이해가 향상되면서 2000년대 초반부터 악성 세포의 특정 분자 경로를 표적으로 하는 약제의 개발이 시작되었습니다. 희망은 이러한 약제가 악성 세포를 우선적으로 죽일 수 있지만 정상 세포에는 상대적으로 무해하다는 것입니다. 많은 확립된 표적 요법이 경구 이용 가능한 small-molecule kinase inhibitors로 투여되지만, 표적 요법은 단일클론항체 또는 소분자 (small molecules)의 형태로 정맥내 투여될 수도 있습니다.
★ 일부 진행성 NSCLC 종양, 특히 epidermal growth factor receptor (EGFR)의 돌연변이, anaplastic lymphoma kinase (ALK) gene 또는 c-ROS oncogene 1 (ROS1) gene의 재배열에서 특정 tyrosine kinases의 oncogenic activation의 확인은 패러다임 전환과 특정 분자 치료법의 개발로 이어졌습니다.

진행성 NSCLC에서 표적 치료의 효능을 예측하는 데 가장 유용한 바이오마커 (biomarkers)는 "driver mutations"로 알려진 somatic genome alterations입니다. 이러한 돌연변이는 암세포에서 세포 성장과 생존에 중요한 단백질을 암호화하는 유전자 내에서 발생합니다. NSCLC에서 oncogenic phenotype을 유지하는 데 훨씬 덜 필수적인 많은 다른 재발성 molecular alterations이 확인되었으며 종종 "passenger mutations."라고 합니다.Driver mutations은 일반적으로 host의 germline (noncancer) genome에서 발견되지 않으며 일반적으로 상호 배타적입니다(즉, 암에 두 개 이상의 driver mutation가 있을 가능성이 낮음)

Driver mutations는 일반적으로 변형되며 이는 비암성 세포 (noncancerous cell)에서 악성으로의 진화를 시작한다는 것을 의미합니다. 또한, Driver mutations는 종종 변형된 세포 (transformed cell)에 oncogene-addicted biology를 부여하는데, 이는 돌연변이된 단백질이 생존하기 위해 driver로부터 signal을 받도록 암세포 내에서 의존성을 낳는다는 것을 의미합니다.
자주 사용되는 비유는 정상적으로 작동하는 세포는 회로에 특정 스위치를 가지고 있고 이 스위치는 때때로 켜지고 때로는 꺼지지만 일반적으로 feedback inhibition loops와 특정 stimulators로 조절됩니다. 그러나 oncogene-addicted cancer cell에서는 스위치가 항상 켜져 있는 상태에 머물러 있어 더 이상 조절 대상이 아닙니다.
Oncogene addiction은 driver mutations을 표적 치료를 위한 환자 선택의 좋은 바이오마커로 만드는 경향이 있습니다. "on 위치에 고정된" single upstream signal에 대한 세포의 중요한 downstream growth 및 survival pathways의 극단적인 의존은 아킬레스건 역할을 하여 암을 driver로부터 발생하는 signal의 downregulation에 독특하게 취약하게 만듭니다 (즉, downstream signals flowing을 유지하는 다른 메커니즘이 존재하지 않기 때문에 표적 약물이 본질적으로 스위치를 꺼짐 위치로 돌리면 생존할 수 없습니다)
NSCLC 및 기타 악성 종양에서 특정 표적 약물을 확인된 driver mutation과 일치시키면 종종 독성 감소와 함께 치료 효능이 상당히 개선되었습니다. 따라서 driver mutations에 대한 스크리닝은 NSCLC에 대한 진단 작업의 점점 더 표준적인 부분이 되었으며, 결과 정보는 driver mutations이 없는 표준 화학요법과 선행 표적 요법 사이에서 약제 선택하는 데 유용합니다. 예를 들어, 모든 폐암에 대해 분자 프로파일링을 실시한 프랑스 전국 연구에서 종양의 약 50%가 유전적 변이를 보여 이 사례의 절반에서 표적 약제를 1차 요법으로 사용하게 되었습니다. Genetic alteration의 존재는 개선된 1차 progression-free survival (10개월 대 7.1개월) 및 전체 생존 (16.5개월 대 11.8개월)과 관련이 있었습니다.
비소세포폐암의 유전형

2022 NCCN 가이드라인
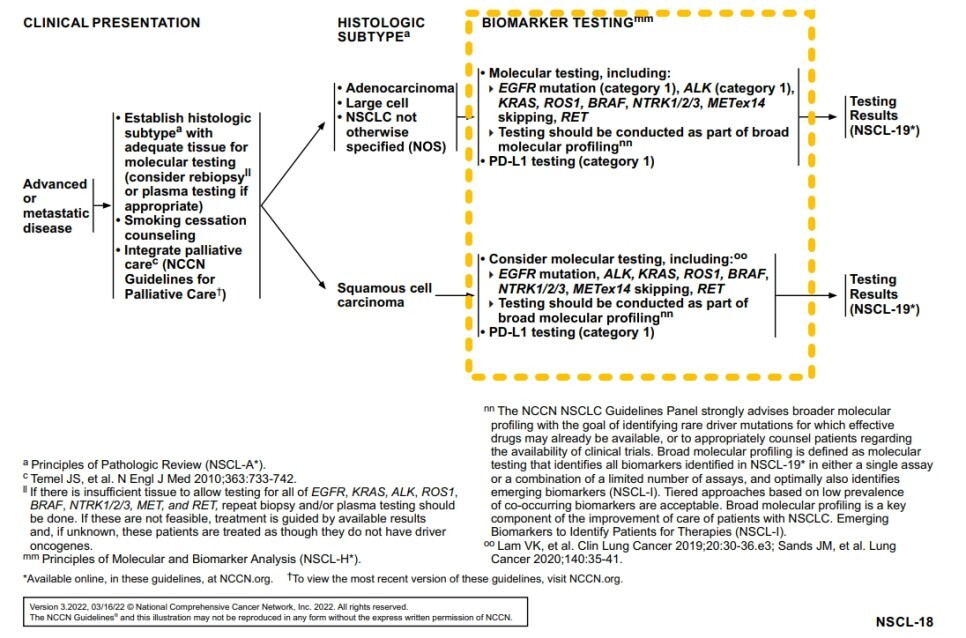
★ 비소세포폐암이 확인되면 바이오마커 검사를 시행해야 합니다.

■ 2022.04월 기준
|
1) Category 1 - EGFR, ALK
|
||
|
2)우리나라 보험 급여 - EGFR, ALK, ROS1, BRAF V600E, NTRK
|
||
|
3) NCCN target - EGFR, ALK, ROS1, BRAF V600E, NTRK, MET, RET, KRAS G12C, EGFR exon 20 insertion mutations
|


가능하다면 진행성 NSCLC 환자에서 driver mutation의 존재에 대해 평가를 해야 합니다. 추가적으로 선순위 면역 치료 사용을 알기 위해 새롭게 진단된 진행성 비소세포폐암 모든 환자에서 일상적인 programmed cell death ligand 1 (PD-L1) 검사를 권고합니다.
NSCLC에서 악성 종양을 유발하는 분자 경로에 대한 향상된 이해는 악성 세포의 특정 분자 경로를 표적으로 하는 약제의 개발로 이어졌습니다. 이들 약제는 이 경로에 특정 mutation을 포함하는 종양을 가지고 있는 환자의 치료에서 중요한 진전을 이뤘습니다.
EGFR mutation 양성
Epidermal growth factor receptor (EGFR) tyrosine kinase inhibitors ([TKIs] osimertinib, erlotinib, gefitinib, afatinib)를 단일 약제로 사용하는 치료는 EGFR의 activating mutation을 포함하는 종양을 가진 환자에서 필요합니다. 이것은 확인된 driver mutation를 가지고 있는 환자에서 항암치료와 면역치료보다 선호됩니다.
이러한 상황에서 EGFR TKI를 사용한 1차 치료는 standard platinum-based chemotherapy에 비해 결과를 개선시킵니다. EGFR TKI가 이 접근법의 효능을 입증하는 임상 시험에서 화학요법 후 2차 요법으로 자주 사용되었기 때문에 OS에 대한 영향은 덜 분명합니다. EGFR TKI 중에서 osimertinib은 erlotinib 및 gefitinib에 비해 progression free survival (PFS) 개선을 입증했으며 우리가 선호하는 최전선 약제입니다.

EGFR TKI는 초기 요법으로 platinum-based doublet chemotherapy와 병합하지 않는데 그 이유는 독성이 증가하기도 하거니와 우리가 선호하는 초기 치료인 오시머티닙을 일상적으로 사용하기 전에 시험이 수행되었다는 사실 때문입니다. 그러나 최전선 환경에서 1세대 EGFR 억제제와 화학요법을 조합한 결과는 고무적이며 추가 연구 가치가 있습니다.
심각한 독성이 없는 경우 진행의 증거가 있을 때까지 EGFR TKI 치료를 계속합니다. 신중하게 선택한 환자 (예: 국소 요법으로 치료할 수 있는 고립된 재발 부위, 극도로 경미하고 무증상 진행의 환자)에서 EGFR TKI 요법은 진행성 질환의 초기 증거 후에 계속될 수 있습니다. 진행되어 화학요법을 추가하는 경우 EGFR TKI 치료를 중단해야 합니다.

종양 성장 및 진행은 cell proliferation, apoptosis, angiogenesis, adhesion, motility.을 조절하는 세포내 신호 전달 경로를 제어하는 cell surface membrane receptors의 활성에 의존합니다.
이러한 세포 표면 수용체에는 EGFR (HER1 또는 erbB-1이라고도 함) tyrosine kinases (TK)가 포함됩니다. EGFR은 세포 표면에 monomer로 존재하며 TK를 활성화하려면 dimerize해야 합니다. EGFR의 TK 활성은 정상 세포에서 엄격하게 제어되지만 이러한 수용체를 코딩하는 유전자는 악성 세포에서 일반적인 intracellular inhibitory mechanisms에서 벗어날 수 있습니다.
EGFR의 특징적인 mutations, exon 19 deletions 또는 exon 21 L858R mutations를 포함하는 진행성 NSCLC는 EGFR TK 억제제 (TKI)에 매우 민감합니다. EGFR의 driver mutation의 존재 여부에 대한 분석은 진행성 NSCLC 환자의 초기 치료에 EGFR TKI를 사용할지 여부를 결정하는 표준 접근 방식입니다. 여러 신뢰할 수 있는 기술을 사용하여 EGFR mutations를 분석할 수 있으며 이는 포르말린 고정 조직에서 가능합니다.
EGFR tyrosine kinase의 돌연변이는 미국에서 NSCLC 선암종의 약 15%에서 관찰되며 여성과 비흡연자에게서 더 자주 발생합니다. 아시아인 인구에서 EGFR mutations의 발생률은 상당히 높습니다.
PIONEER 연구에서는 아시아 7개 지역 (중국, 홍콩, 인도, 필리핀, 대만, 태국, 베트남)에서 1482명의 선암 환자를 대상으로 종양을 분석했습니다. EGFR mutations의 발생률은 22~62%였습니다. 비흡연자에서 EGFR mutations이 더 흔했지만, 일반 흡연자의 발병률은 여전히 37%였습니다. 이러한 mutations의 빈도는 남성보다 여성에서 더 높았지만 흡연 빈도를 고려할 때 그 차이는 유의하지 않았습니다.
유전자형 검사 결과가 나오기 전에 전신 치료가 필요한 경우 systemic chemotherapy를 시행합니다. 화학요법 시작 후 EGFR 돌연변이가 확인되면 치료를 견딜 수 있고 질병 진행의 증거가 없는 한 4주기 동안 화학 요법을 계속할 것을 제안합니다. 유전자형 검사 결과가 나오면 치료 계획을 재평가해야 합니다. 화학 요법이 시작된 후 동인 돌연변이가 확인되었을 때 최적의 접근 방식을 직접적으로 다루는 임상 시험은 없습니다.
초기 연구에서는 EGFR TKI에 대한 높은 반응률 및 비교적 유리한 예후와 관련된 여러 임상 매개변수를 확인했습니다. 여기에는 선암종 조직학, 여성, 비흡연자 및 아시아 민족이 포함됩니다. 후속 연구에서는 이러한 임상 매개변수가 EGFR tyrosine kinase domain의 특정 활성화 돌연변이 (exon 19 deletions, L858R point mutation in exon 21)의 존재에 대한 대리표지자임을 보여주었습니다. 그러나 임상 프로파일링이 매우 정확하지 않기 때문에 임상 매개변수가 실제 mutational testing를 대체해서는 안 됩니다.

EGFR tyrosine kinase inhibitors (TKIs)는 platinum-based chemotherapy doublets과 비교하여 EGFR의 activating mutation을 포함하고 있는 진행성 NSCLC 환자의 결과를 유의하게 개선시킵니다.
1세대 (erlotinib, defitinib) 및 2세대(afatinib) TKIs가 EGFR의 초기 관리를 위한 표준 치료였지만 새로운 데이터는 3세대 제제인 osimertinib을 사용한 최전선 치료로 개선된 결과를 시사합니다. 이러한 데이터를 감안할 때, 이전 세대 EGFR TKI가 여전히 허용 가능한 대안으로 남아 있지만, 우리는 osimertinib을 최전선 치료 옵션으로 선호합니다.
1세대 TKI가 advanced EGFR-mutant NSCLC의 표준 최전선 치료였지만, 최신 데이터는 gefitinib 또는 erlotinib과 비교하여 최전선 치료제 osimertinib에서 개선된 생존 결과를 보여줍니다. 오시머티닙은 현재 미국 식품의약국(FDA)에서 종양에 EGFR exon 19 deletions 또는 exon 21 L858R mutations이 있는 metastatic NSCLC 환자의 1차 치료제로 승인되었습니다.
III상 FLAURA 시험에서 치료 경험이 없는 EGFR-mutated advanced NSCLC 환자 556명을 대상으로 osimertinib 대 standard of care (SOC) EGFR TKI (gefitinib 또는 erlotinib)를 할당하였습니다. 이 연구에서는 중추신경계 전이가 있는 신경학적으로 안정적인 환자가 허용되었습니다. Osimertinib은 SOC에 비해 PFS (18.9 대 10.2개월), HR (0.46, 95% CI 0.37-0.57) 및 반응 지속 기간 (17.2 대 8.5개월)의 개선을 입증했습니다. PFS 이득은 뇌 전이가 있거나 없는 환자를 포함하여 하위 그룹에 걸쳐 일관되었습니다.
오시머티닙은 QTc 연장 및 좌심실 박출률 감소와 관련이 있으며 이는 약물 중단으로 가역적입니다.


이전 블로그 : 타그리소 (오시머티닙) : https://blog.naver.com/sjloveu2/222360766596
Ref. 2022 춘계 송파구의사회 학술대회 3탄
UpToDate 2022.06.14
NCCN guideline 2022





