2024.05.01 철분주사제 급여 기준과 '페린젝트주'(성분명 : 페릭 카르복시말토즈, JW중외제약) 【고용량 철분 주사제】
■ 고시 개정 전체내용
허가사항 범위 내에서 아래와 같은 기준으로 투여한 경우로서 요양급여비용 청구 시 매월 혈액검사 결과지, 철결핍을 확인할 수 있는 검사결과지, 투여소견서가 첨부된 경우에 요양급여를 인정하며, 동 인정기준 이외에는 약값 전액을 환자가 부담토록 함.
- 아 래 -
가. 일반 환자
1) 헤모글로빈(Hb) 10g/dL(단, 임신부는 11g/dL) 이하이고 경구투여가 곤란한 경우로서 출혈 등이 있어 철분을 반드시 신속하게 투여할 필요성이 있는 철결핍성 빈혈 환자로 혈청 페리틴(Serum ferritin) 30ng/mL 미만 또는 트랜스페린 포화도(Transferrin saturation) 20% 미만인 경우
2) 수술, 출산 등으로 인한 출혈로 신속한 투여가 필요한 환자는 Hb 10g/dL 이하인 경우
나. 투석중이 아닌 만성신부전증 환자
Hb 10g/dL 이하인 경우에 투여하고, 목표(유지) 수치는 Hb 11g/dL까지 요양 급여를 인정하며,
○ Serum ferritin 100ng/mL 미만 또는 Transferrin saturation 20% 미만인 경우(다만, 경구투여가 곤란한 경우만 인정)
다.투석중인 만성신부전증 환자(다만, ferric hydroxide carboxymaltose complex 주사제는 제외)
Hb 11g/dL 이하인 경우에 투여 시 인정하며,
1) 혈액투석환자는 Serum ferritin 200ng/mL 미만 또는 Transferrin saturation 20% 미만인 경우
2) 복막투석환자는 경구투여가 곤란한 경우에 한하여 Serum ferritin 100ng/mL 미만 또는 Transferrin saturation 20% 미만인 경우
3) 충분한 양의 Erythropoietin 주사제를 투여함에도 빈혈이 개선되지 않는 Erythropoietin 주사제 저항인 경우에는 Serum ferritin 300ng/mL 미만 또는 Transferrin saturation 30% 미만인 경우
라. 항암화학요법을 받고 있는 비골수성 악성종양을 가진 환자
Hb 10g/dL 이하인 경우로서
1) 경구투여가 곤란한 환자로 Serum ferritin 100ng/mL 미만 또는 Transferrin saturation 20%미만인 경우
2) 충분한 양의 Erythropoietin주사제를 투여함에도 빈혈이 개선되지 않는 Erythropoietin주사제 저항인 경우에는 Serum ferritin 300ng/mL 미만 또는 Transferrin saturation 30%미만인 경우
※ 대상약제
·iron hydroxide sucrose complex 주사제(품명: 베노훼럼주 등)
·ferric hydroxide carboxymaltose complex 주사제(품명: 페린젝트주)
■ 고시 개정 고시번호(시행일자)
고시 제2024-72호(2024.5.1.)
■ 고시 개정 사유
○국내·외 허가사항, 관련문헌(교과서, 임상진료지침, 임상연구문헌 등) 및 학회의견(전문가의견) 등을 참조하여, 철분주사제 급여기준에 페린젝트주를 추가함.
■ 변경 전 고시번호(시행일자)
고시 제2020-79호 (2020.5.1)
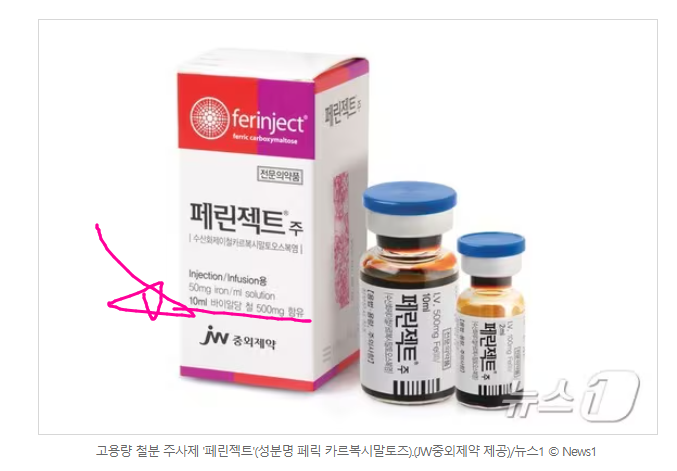
페린젝트주 【고용량 철분 주사제】
- 성분명 : 페릭 카르복시말토즈, Ferric carboxymaltose
- JW중외제약
철분제는 경구제와 주사제가 있습니다.
주사제 종류에는 여러 가지가 있고 ferric carboxymaltose (FCM)는 그 중 한 개입니다.
FCM (페린젝트 Ferinject, Injectafer)는 다른 IV 제제보다 탄수화물 중합제에 elemental iron이 더 단단히 결합된 colloidal iron hydroxide complex입니다.
이 주사제를 사용 시 주의할 점은 hypophosphatemia 우려 때문에 hypophosphatemia 위험이 있는 사람에서는 사용하지 않습니다. 이와 같은 경우로는 inflammatory bowel disease, bariatric surgery, excess alcohol, trauma, sepsis, diabetes, impaired oral intake가 있습니다. Some experts have suggested minimizing the use of FCM altogether due to this risk.
FCM은 단 회 1000 mg of elemental iron (20 mL of a solution of 50 mg elemental iron/mL)까지 투약할 수 있습니다. mL당 50 mg elemnental iron이 들어 있으므로 20 mL는 1000 mg elemental iron이 포함되어 있습니다. 페린젝트주는 2 mL, 10 mL, 20 mL 3가지 제품 종류가 있습니다. European product labeling specifies a maximum single dose of 20 mg/kg of body weight. Product labeling in the United States specifies a maximum single dose of 15 mg/kg of body weight.

FCM은 15분에 걸쳐 주사합니다. 모든 다른 주사제처럼 느린 속도로 시작하며 알레르기 또는 infusion reaction을 관찰합니다. 만일 없다면 15분 동안 균일하게 주사합니다. 적절하게 투약되었다면 다른 날 또 다른 주사제를 주사할 수 있으며, 미국은 7일 간격을 권고합니다. 그러나 유럽은 이러한 방법을 따르지 않으며 이것을 지지할만한 임상적 증거는 없습니다.
혈청 인 (phosphate) 수치는 FCM을 1회보다 많이 투여하는 모든 환자에게 측정될 필요가 있습니다. 다음 반복적 투여 전에 혈청 인을 측정해야 합니다. 특히 기저 수치가 경계 수치였던 환자 또는 FCM을 반복적으로 투여 받는 사람에서 중요합니다. 우리는 이러한 사람에서는 다른 제형을 사용합니다.
저인산혈증 (hypophosphatemia)의 기전 : FCM 투여로 이후 감소된 FGF-23 degradation으로 인한 증가된 혈청 FGF-23으로 인해 소변을 통한 인의 배설이 증가되는 것과 관련이 있는 것 같습니다. 기전은 아직 불명확합니다.
|
Supporting evidence – A number of trials have shown efficacy and safety of FCM in iron-deficient patients in a number of different settings including heavy uterine bleeding, postpartum, nondialysis-dependent chronic kidney disease, inflammatory bowel disease, heart failure, chemotherapy-associated anemia without concomitant use of an ESA, and nonresponse to oral iron. Several series have reported use of FCM during pregnancy without serious adverse events
|
Ref. UpToDate 2024.05.04